Активация Т-лимфоцитов
Под активацией клеток понимают их переход из состояния покоя в функционально активное состояние — макрофаги продуцируют активные формы кислорода, тучные клетки выбрасывают гранулы, мышечные клетки сокращаются и т.д. В случае лимфоцита активация также означает выход из состояния покоя (G0), но в несколько ином смысле: покоящийся лимфоцит находится вне клеточного цикла, а его активация означает вступление в цикл. Это последствие активации лимфоцитов глубоко функционально, поскольку любому проявлению функции лимфоцитов должно предшествовать их размножение (поскольку исходная численности клеток в каждом клоне мала). Это не относится к естественным киллерам — лимфоцитам, популяция которых не имеет клональной структуры. Активация NK-клеток не связана с пролиферацией и означает переход в состояние готовности выполнять цитотоксическую функцию.
Молекулярные основы активации Т-клеток
Активация клеток, в том числе лимфоцитов, всегда сопряжена с экспрессией многих генов. В случае лимфоцитов активация должна приводить прежде всего к экспрессии генов, обеспечивающих пролиферативную экспансию клона. Суть подготовки Т-клеток к пролиферации состоит прежде всего в экспрессии генов аутокринного ростового фактора — IL-2 и его рецептора, а точнее a-цепи этого рецептора, обеспечивающей достижение необходимого уровня сродства к цитокину, что служит условием выполнения рецептором его функций. Оба эти гена являются индуцибельными, т.е. в покоящемся состоянии они выключены, но экспрессируются в ответ на индуцирующее воздействие. Сигнал к включению гена поступает из его регуляторного (промоторного) участка, в котором расположены сайты специфического взаимодействия с определенными белками — транскрипционными факторами. Некоторые их таких белков исходно представлены в клетке в активной форме, но большинство отсутствует и может быть синтезировано de novo или активировано путем фосфорилирования или удаления ингибирующей субъединицы. Таким образом, молекулярная основа активации — образование необходимых транскрипционных факторов, обеспечивающих включение индуцибельных генов.
На Т-лимфоциты активирующее воздействие оказывают индукторы активации. В физиологических условиях таким индуктором служит антигенный стимул. Само по себе распознавание антигена при контакте Т-хел- пера с АПК не может повлиять на активность гена в силу пространственной разобщенности мембранного рецептора и генов, локализующихся в ядре. TCR проникает внутрь клетки после связывания с антигеном, но не для того, чтобы мигрировать в ядро и повлиять на активность гена, а для того, чтобы быть расщепленным. Однако при связывании антигенного комплекса с TCR в сочетании с костимулирующим воздействием возникает сигнал, достигающий ядра и регулирующий экспрессию генов. Передача сигнала осуществляется по каскадному принципу. На разных этапах передачи сигнала ее осуществляют молекулы ферментов (главным образом, протеинкиназы, активирующие белки на каждой очередной стадии передачи сигнала), а также адапторные и ГТФ-связывающие белки. Сигнал исходно является двойственным, поскольку его передача осуществляется одновременно от TCR и CD28. Затем эти пути пересекаются и вновь разделяются на несколько ветвей. Конечный результат передачи сигнала по каждому сигнальному пути — формирование транскрипционного фактора. На рис. 3.90 представлена типовая схема внутриклеточной передачи сигнала, завершающейся формированием транскрипционных факторов и активацией генов. Для активации Т-клеток требуется формирование трех транскрипционных факторов — NF-AT, NF-kB и AP-1. Далее рассмотрим осуществление внутриклеточной передачи сигнала на примере активации Т-хелперов при распознавании презентируемого дендритными клетками антигена.
Связывание комплекса MHC-II—пептид вызывает конформационные изменения молекулы TCR и связанной с ней молекулы корец ептора CD4. Пока окончательно не известно, происходит ли при этом только изменение конформации рецепторов или они олигомеризуются. Такие изменения активируют тирозинкиназы, ассоциированные с рецептором и корецеп- тором — Lck (p56lck), связанную с CD4, и Fyn (p59fyn), связанную с CD3. Указанные тирозинкиназы называют рецепторными, или проксимальными, в связи с тем, что они непосредственно примыкают к рецептору, входя в рецепторный комплекс. Обе упомянутые киназы относят к семейству Src-киназ. Киназы этого семейства содержат домены SH1, SH2 и SH3 (SH — от Src-homology) (рис. 3.91). Первый домен обладает ферментативной активностью, остальные взаимодействуют с другими киназами и адапторными белками. Функция тирозинкиназ состоит в фосфорилировании по остатку тирозина белков-мишеней, что необходимо для их активации и проявления функций, в том числе ферментативных. Мишени рецепторных киназ многочисленны. К ним относят сами молекулы Fyn и Lck (что обусловливает их аутофосфорилирование), а также полипептидные цепи TCR и другие киназы. Особенно многообразны мишени киназы Lck.
Однако первоначальным условием активации рецепторных киназ является, наоборот, их дефосфорилирование, обеспечивающее пере-
ход из гиперфосфорилированного в нормальное состояние. Дело в том, что в покоящейся клетке SH2-домен киназы Lck находится в свернутой форме вследствие фосфорилирования С-концевого остатка тирозина Y505 конститутивно активированной киназой Csk. Фосфорилированный Y505 взаимодействует с помощью фосфатной группы с остатком тирозина в Sffi-домене, к которому и подтягивается С-конец молекулы. В таком виде фермент не активен, поскольку при этом не может быть фосфори- лирован функционально важный остаток Y394 в домене SH1. Для снятия такой функциональной блокады необходимо дефосфорилирование с последующим развертыванием молекулы, что осуществляется с участием тирозинфосфатаз. Основную роль в переводе рецепторных киназ в «рабочее» состояние выполняет молекула CD45, цитоплазматический домен которой обладает активностью тирозинфосфатазы. Ранее уже упоминалось, что эта крупная молекула, препятствующая формированию тесного контакта между дендритной клеткой и Т-хелпером, вначале удаляется из зоны иммунного синапса, а затем часть молекул возвращается в эту зону для выполнения своей функции — дефосфорилирования молекул рецепторных тирозинкиназ. После того как остаток Y394 становится доступным для фосфорилирования, Lck может проявлять активность тирозинкиназы.
В генерации сигналов, передаваемых от полипептидных цепей комплекса TCR—CD3, наиболее важно наличие в цитоплазматическом участке у-, 5-, е- и Z-цепей активационной последовательности ITAM, о которой уже неоднократно упоминалось. Структура этого мотива такова: YXXI/L/ VX(6—8)YXXI/L/V (где Y — тирозин, Х — любой остаток, I/L/V — изолейцин, лейцин или валин) (рис. 3.92). Фосфорилирование остатков тирозина

Рис. 3.92. Сопоставление характеристик активационных и ингибирующих мотивов (ITAM и ITIM)
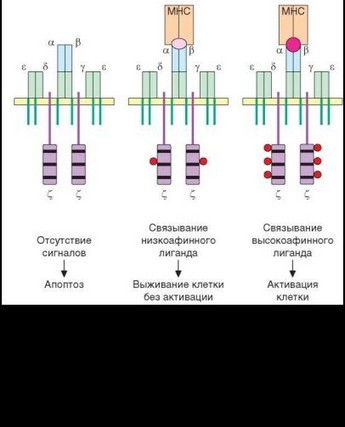
в ITAM делает этот участок доступным для распознавания аналогичными участками сигнальных молекул, расположенных более дистально. Среди полипептидных цепей TCR наиболее важна для передачи сигнала Z-цепь. В отличие от у-, 5- и е-цепей TCR, имеющих по одному участку ITAM, в цитоплазматической части Z-цепи расположены 3 последовательности ITAM, предназначенные для взаимодействия с остатками тирозина тирозинкиназы ZAP-70 (от Z-associated protein — ^-ассоциированный белок; масса 70 кДа) — ключевого фактора в передаче сигнала от TCR при его связывании с лигандом. Фосфорилирование Z-цепи является наиболее ответственным и в то же время наиболее уязвимым этапом активации Т-клеток. Полагают, что именно для обеспечения фосфорилирования всех мотивов ITAM этой молекулы необходимо длительное поддержание контакта Т-лимфоцитов и дендритных клеток. В Z-цепи покоящейся Т-клетки фосфорилирован 1 остаток тирозина; отсутствие фосфорилирования приводит к развитию апоптоза (рис. 3.93). После взаимодействия Z-цепи и ZAP-киназы запус-
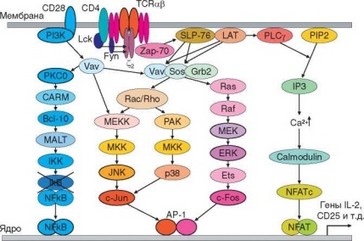
Рис. 3.94. Схема сигнальных путей при активации Т-клеток. Распознавание комплекса молекулы МНС с антигенным эпитопом в сочетании с костимуляцией индуцирует запуск сигналов, передаваемых в ядро с помощью 5 каскадов, обеспечивающих формирование 3 транскрипционных факторов, необходимых для активации клетки. Жирным контуром обведены факторы, для которых показана высокая степень зависимости от костимуляции
кается полномасштабный процесс в виде нескольких параллельных путей передачи активационного сигнала (рис. 3.94).
Молекулу ZAP-70 относят к тирозинкиназам семейства Syk. Она содержит тандем из двух SH2-доменов. Условие ее взаимодействия с фцепью — предварительное фосфорилирование остатков тирозина в ITAM фцепи. После фосфорилирования 2-й остаток тирозина в мотивах ITAM фцепи взаимодействует с тирозином S^-доменов киназы ZAP-70. В результате фосфатная группа тирозина фцепи становится общей с тирозином Sffi-домена молекулы ZAP-70. За этим следует фосфорилирование остатков тирозина в ферментативном домене молекулы ZAP-70, осуществляемое тирозинкиназами Lck и, возможно, Fyn, что приводит к включению ферментативной (киназной) активности молекулы.
Дальнейшая передача сигнала обусловлена взаимодействием ZAP-70 с ее главным субстратом — адапторным белком LAT (от Linker for activation of T-cells — линкер активации Т-клеток). Этот белок связан с мембраной и входит в состав рафтов. После катализируемого ZAP-70 фосфорилирования LAT приобретает способность связывать сигнальные молекулы, участвующие в дальнейшей передаче сигнала: адапторные белки SLP-76, Grb2, фактор Vav, а также ферменты — PLCy1 и PI3K. Активация некоторых из упомянутых белков зависит от LAT не напрямую, а косвенно. Так, через SH3-домены
адапторных белков семейства Grb2 к сигнальному пути подсоединяются факторы SLP-76 и Sos. SLP-76, в свою очередь, опосредует подключение к сигнальному пути PLСy1 и ГТФазы Ras. Активация PLCy1 происходит с участием тирозинкиназы Itk, относящейся к семейству Btk — третьему (после Src и Syk) семейству тирозинкиназ, участвующих во внутриклеточной передаче сигнала при активации лимфоцитов. Все сигнальные факторы, вовлекаемые в процесс активации с прямым и косвенным участием LAT, рекрутируются в состав клеточной мембраны и взаимодействуют с ее фосфоинозитидными компонентами. Комплекс, образуемый при взаимодействии SLP-76, Vav и Nck, реагирует с белками цитоскелета PAK и WASP, служащими медиаторами перестроек в цитоскелете активируемых клеток.
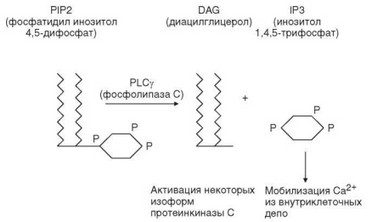
Активированная PLCy1 катализирует расщепление фосфатидилино- зитол 4,5-бифосфата с образованием диацилглицерола (DAG), который остается связанным с мембраной, и инозитол-1,4,5-трифосфата (рис. 3.95). Инозитол трифосфат поступает в цитоплазму и взаимодействует с рецепторами на поверхности эндоплазматического ретикулума, что обусловливает выход ионов Са2+ из внутриклеточных хранилищ. Опустошение последних вызывает открытие Са2+-зависимых каналов в клеточной мембране, через которые в клетку поступают ионы Са2+ из внеклеточного пространства. В результате возрастает концентрация свободных ионов Са2+ в цитоплазме клетки. Ионы Са2+ активируют фосфатазу кальциневрин, дефосфорилиру- ющую цитоплазматический компонент транскрипционного фактора NF-AT (Nuclear factor of activated T-cells — ядерный фактор активированных Т клеток) (рис. 3.96). Это обусловливает перемещение фактора в ядро, взаимодействие с ядерным компонентом и формирование зрелой формы молекулы NF-AT, способной взаимодействовать с ДНК в промоторных участках генов, вовлеченных в активацию Т-клеток (IL2, IL2R и др.).
Диацилглицерол традиционно рассматривали как фактор, активирующий протеинкиназу С (PKC) — уже не раз упоминавшуюся ранее серин/тре-
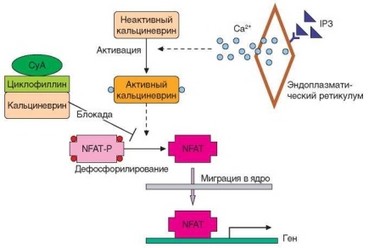
Рис. 3.96. Са2+-зависимое звено активации Т-клеток и его блокада циклоспорином А. Зависимый от инозитолтрифосфата сигнальный путь приводит к мобилизации в ядро транскрипицонного фактора NF-AT. Этот путь может быть блокирован циклоспорином А, способным в комплексе с циклофиллином инактивировать фосфатазу кальциневрин, ответственную за дефосфорилирование цитоплазматического фактора NF-AT (что служит условием его миграции в ядро)
ониновую киназу, признаваемую одним из ключевых факторов активации Т-клеток. Однако оказалось, что изоформы РКС, активируемые диацил- глицеролом, не имеют отношения к активации Т-клеток. В ней участвует изоформа 0 РКС, появляющаяся в иммунном синапсе на пике его «зрелости». Ее рекрутирование в иммунный синапс зависит от активности Р13К и Vav (последний фактор связан с цитоскелетом, роль которого в транспорте РКС0 очень важна). Поскольку активация Vav зависит от сигнализации не только через TCR, но и через CD28, а CD28-зависимый путь реализуется с участием PI3K (она ассоциирована с CD28 — см. далее), становится очевидным, что PI3K и Vav представляют различные этапы одного сигнального пути и, таким образом, вовлечение в активацию молекулы РКС0 зависит от костимуляции через CD28. При этом не вызывает сомнений роль в активации РКС0 сигналов, поступающих от TCR, поскольку РКС0 фосфорили- руется (и, следовательно, активируется) киназой Lck. Допускают участие в активации РКС0 и других факторов, в том числе диацилглицерола, но эти влияния второстепенны. Активация PKC0 необходима для предотвращения апоптоза активируемых клеток и включения двух из трех критических транскрипционных факторов, необходимых для экспрессии генов IL2 и IL2R — АР-1 и NF-kB. РКС0-зависимая активация АР-1 реализуется через Rac/JNK-ветвь MAP-каскада (о нем будет сказано далее). Путь, приводящий к активации транскрипционного фактора NF-kB, содержит в качестве
промежуточных звеньев последовательно активируемые (с участием PKC0) факторы CARMA-1, Bcl-10 и MALT-1, IKK. IKK фосфорилирует ингибирующую субъединицу NF-kB — IkK, придавая ей способность к связыванию убиквитина, что предопределяет ее последующую деградацию. При этом освобождается активная субъединица NF-kB, мигрирующая в ядро и выступающая в роли транскрипционного фактора — одного из трех, необходимых для экспрессии генов активации Т-клеток. Транскрипционный фактор NF-kB, играющий ключевую роль при активации клеток врожденного иммунитета, был рассмотрен выше (см. раздел 2.2.4).
Столь же широко при активации клеток используется еще один сигнальный путь, запускаемый при активации Т-лимфоцитов — MAP-каскад, или MAP-модуль (от Mitogen-activated kinases — киназы, активированные мито- геном). Его роль состоит главным образом в индукции транскрипционного фактора АР-1 (димера c-jun/c-fos). Существует 3 ветви этого каскада, приводящие к образованию трех типов MAP-киназ (MAP^ — ERK1/ERK2 (от Extracellular signal-regulated kinases — киназы, регулируемые внеклеточными сигналами), p38 и JNK (от c-Jun NH2-terminal kinases — c-Jun NH2-концевые киназы). Каскады, приводящие к активации MAP-киназ, включаются с участием адапторных белков и низкомолекулярных ГТФаз. Один из адап- торных белков — Grb2 (Growth factor receptor bound protein 2), активируется при взаимодействии с фактором LAT. Активированный Grb2 спонтанно связывается с другим LAT-активированным белком SLP-76 и фактором Sos (от Son of sevenless). Sos представляет фактор замещения гуаниннуклеотидов: он обусловливает замещение ГДФ на ГТФ в составе малых G-белков (т.е. белков, связывающих гуаниннуклеотиды). Поэтому комплекс SLP-76/Grb2/Sos обусловливает активацию G-белка Ras, превращая связанный с ним ГДФ в ГТФ. Ras-ГТФ активирует серин/треониновую киназу Raf (киназу киназы MAP-киназы — МККК). Далее следует каскад реакций: Raf активирует МЕК (киназу MAP-киназы — МКК), а МЕК активирует вышеупомянутые MAP-киназы ERK1 и ERO. Активацию JNK-ветви MAP-каскада инициирует упоминавшийся выше фактор Vav (зависимый от LAT и связанный с активацией цитоскелета, а также РКС0, см. выше). Он вызывает переход ГДФ в ГТФ в комплексе с G-белком Rac (семейство Rho). Rac-ГТФ активирует киназу МЕКК (выступающую в роли МККК), она активирует киназу JNKK (MKK), которая, в свою очередь, активирует MAP-киназу JNK. Третий путь MAP-модуля, приводящий к образованию MAP-киназы р38, также зависит от G-белков семейства Rho. Он аналогичен по общей схеме двум другим путям, но изучен менее детально.
Активация MAP-киназ ERK1/ERK2, JNK и p38 осуществляется путем фосфорилирования остатков треонина и тирозина в мотиве TXY, причем роль Х в трех типах киназ выполняют различные остатки (соответственно Glu, Pro и Gly). Названные MAP-киназы обусловливают формирование транскрипционных факторов, участвующих во многих клеточных процессах. ERK1/ERK2 обусловливает образование транскрипционных факторов АР-1 и Elk-1, JNK — факторов ATF2, Elk-1 и c-Jun (компонент АР-1), p38 — факторов ATF2, Elk-1 и MEF-2C.
Запуск рассмотренных выше сигнальных путей при активации Т-клеток происходит при параллельном связывании TCR и костимуляции через молекулу CD28. Дифференцирование сигнальных путей, включаемых через эти мембранные молекулы, а также расшифровка взаимодействия этих путей до конца не завершены. Однако общая картина проявляется достаточно четко, чтобы в общих чертах понять молекулярные основы костимуляции. При связывании TCR, координированном со связыванием корецептора, происходит изменение конформации комплекса TCR—CD3, CD4 вызывает активацию рецепторных тирозинкиназ Fyn и Lck, а также фосфатазы CD45. Конечный результат «проксимальных» событий — фосфорилирование Z-цепи рецепторного комплекса и передача активационного сигнала на киназу ZAP-70. Далее с участием адапторных белков LAT, SLP-76 и Vav область, вовлеченная в передачу сигнала, существенно расширяется, включая мембранно-связанные киназы, цитоскелет и малые G-белки. Сигнальный путь, приводящий (через активацию PLCyl, образование инозитолтрифосфата и активацию кальциневрина) к мобилизации Са2+ и активации транскрипционного фактора NF-AT, по-видимому, реализуется без прямого участия сигналов, генерируемых при костимуляции. Другие пути в большей или меньшей степени зависят от костимулирующего сигнала.
Наиболее прямое следствие костимуляции через CD28 — активация мембранного фермента PI3K, физически связанного с молекулой CD28. Этот фермент катализирует образование фосфатидилинозитол 4, 5-бифосфата, служащего источником инозитолтрифосфата. Однако это событие напрямую не связано с активацией и может рассматриваться как подготовительное. При активации клетки фосфатидилинозитолтрифосфат активирует Vav — узловой фактор, ответственный за вовлечение в процесс активации цитоскелета и участвующий в рекрутировании и активации протеинкиназы PKC0. Этот фермент важен для функционирования сигнального пути, приводящего к формированию транскрипционных факторов NF-kB и АР-1. В обоих случаях роль PKC0 в наибольшей степени проявляется во включении Rас/JNK-ветви MAP-каскада. Raf/ERK- и Rac/p38-ветви MAP-каскада в меньшей степени зависят от PKC0, а следовательно, от костимуляции. Таким образом, молекулярная основа костимуляции — вовлечение в процесс активации Т-хелпера сигнальных путей, реализуемых с участием трех ключевых факторов — PI3K, фактора Vav и изоформы 0 протеинкиназы С. Из трех ключевых транскрипционных факторов, запускающих гены активации Т-клеток, экспрессия двух (АР-1 и NF-kB) зависит от костимуляции и только для выработки NF-AT непосредственно костимуляция не требуется.
Таким образом, в результате в Т-клетке формируется 3 транскрипционных фактора — NF-AT, NF-kB AP-1. Формирование этих факторов происходит различными путями. Активный NF-AT образуется в результате сборки димера, включающего цитоплазматический и ядерный субкомпоненты NF-AT — NF-ATc и NF-ATn. Если NF-ATn — конститутивный фактор, всегда присутствующий в ядре Т-клетки, NF-ATc должен быть активирован для миграции в ядро, что достигается его дефосфорилированием, катализируемым кальциневрином (см. выше). Транскрипционный фактор NF-kB активируется путем отщепления от комплекса IkB-NF-kB ингибирующей субъединицы IkB. Как уже говорилось выше, это происходит при фосфорилировании IkB киназой IKK, активируемой с участием РКС0. Фосфорилированная субъединица становится доступной для деградации
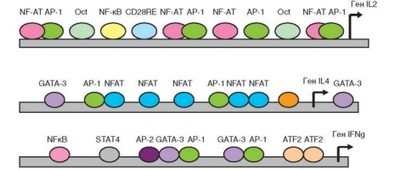
по убиквитиновому пути. Фактор АР-1 — димер белковых продуктов двух индуцибельных протоонкогенов — c-fos и c-jun. Для экспрессии этих генов и синтеза белков необходимы соответствующие транскрипционные факторы, а именно Elk-1 (для c-fos) и JNK (для c-jun). Как уже было указано выше, Elk-1 и JNK — конечные продукты деятельности различных ветвей MAP-каскада. Синтезируемые de novo белки c-fos и c-jun образуют гомо- и гетеродимеры, формирующие транскрипционный фактор АР-1.
Рассмотренные три фактора (NF-AT, NF-kB и AP-1) нужны для индукции генов активации Т-клеток — в первую очередь IL2 и IL2R. Промоторный участок гена IL2 содержит 9 сайтов связывания транскрипционных факторов (рис. 3.97). Среди них есть 2 участка связывания октомера Oct, не лимитирующего процесс индукции гена. Из трех ключевых транскрипционных факторов NF-kB взаимодействует с промотором в одном сайте, не зависимом от других транскрипционных факторов. Два других фактора — NF-AT и AP-1 — взаимодействуют с промотором как отдельно друг от друга (по 1 сайту связывания), так и в комплексе (3 сайта связывания). Заполнение всех сайтов соответствующими транскрипционными факторами, приводящее к индукции гена, служит конечным результатом передачи сигнала при активации Т-клеток.
Выше были подробно рассмотрены сигнальные пути, участвующие в активации Т-хелперов. Активация цитотоксических Т-клеток осуществляется по сходным механизмам.
3.5.2.2. Проявления активации Т-клеток
Активация CD4+ Т-клеток (как и любых Т-лимфоцитов) приводит к экспрессии большого числа генов, среди которых наибольшую роль в реализации основных эффекторных событий играют гены IL2 и IL2R, кодирующие соответственно цитокин IL-2 и a-цепь его рецептора. Экспрессия гена IL2 происходит примерно через 1 ч после получения стимулирующего сигнала. Секрецию белка IL-2 стимулированными Т-клетками in vitro выявляют через 3—4 ч; она достигает пика через 8—12 ч и прекращается через 24 ч. In vivo секреция IL-2 начинается через 1—3 сут после введения антигена
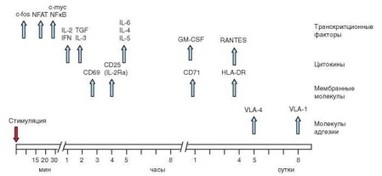
Рис. 3.98. Временная динамика экспрессии молекул активации Т-клеток. На графи
ке представлены сроки экспрессии ключевых молекул активации после стимуляции Т-клеток
(иммунизации) и сохраняется в течение 7—12 сут. Экспрессия a-цепи рецептора IL-2 происходит несколько позже и продолжается дольше — in vitro ее выявляют через 4 ч после стимуляции; максимума она достигает через 2—3 сут и прекращается через 5 сут (рис. 3.98).
Одновременно с геном IL2 в кратчайшие сроки после действия стимулятора (в физиологических условиях — антигенного комплекса пептид—MHC) экспрессируются гены с-Myc и N-Myc, называемые ранними активационными генами. Они участвуют в подготовке клеток к митозу. Через 2—3 ч на поверхности Т-клетки появляется CD69 — самый ранний активационный антиген, частично мобилизуемый из внутриклеточных депо, а частично экспрессируемый de novo. Его экспрессия продолжается немногим более суток. Вскоре после CD69 на поверхности клетки появляется другой ранний маркер активации — CD25, представляющий уже упомянутую a-цепь рецептора для IL-2. Несколько раньше выявляют экспрессию ряда цитоки- новых генов и синтез ограниченных количеств соответствующих цитокинов (IFNy, IL-4, IL-5, IL-6).
Следующие проявления активации наблюдают через сутки после действия стимулятора, когда экспрессируется молекула рецептора для транс- феррина (CD71). Этот фактор играет важную роль в пролиферации, поскольку для ее осуществления необходимы ионы железа. В последующие дни (3—6 сут) экспрессируются молекулы MHC-II, относимые к поздним маркерам активации Т-клеток, а затем — р1-интегрины, обозначаемые как очень поздние активационные антигены — VLA (Very late activation antigens), и секретируются хемокины. Эти поздние проявления активации клеток совмещаются с пролиферативным процессом.
Источник: Ярилин.А.А , «Иммунология » 2010
А так же в разделе «Активация Т-лимфоцитов »
- Презентация антигена
- Миграция клеток, участвующих в презентации антигена
- Иммунный синапс
- Костимуляция
- Пролиферативная экспансия клонов Т-хелперов
- Дифференцировка Т-хелперов
- Th17 и другие адаптивные субпопуляции Т-клеток
- ИММУННЫЙ ОТВЕТ
- Клеточный иммунный ответ
- Воспалительный Т-клеточный иммунный ответ
- Гуморальный иммунный ответ
- Активация В-лимфоцитов. Роль Т-клеток и цитокинов
- Дифференцировка и селекция В-клеток в зародышевых центрах
- Гибридомы и моноклональные антитела. Генно-инженерные антитела
- Иммунологическая память и вторичный иммунный ответ
- В-клетки памяти
- Т-клетки памяти
- Вторичный иммунный ответ
- Неклассические проявления иммунных реакций
- 3.6.4.3. Проявления активности у5Т- и CD8aa+ Т-клеток
- Иммунологические функции NKT-клеток
- Иммунные процессы в слизистых оболочках (мукозальный иммунный ответ)
- Афферентное и центральное звенья мукозального иммунного ответа
- Роль миграции клеток в мукозальном иммунитете
- Эффекторные механизмы мукозального иммунитета
- Контроль и регуляция иммунного ответа
- Генетический контроль иммунного ответа
- Эндокринный и нервный контроль иммунного ответа
- Регуляция иммунного ответа
- Регуляторные Т-клетки
- РЕЗЮМЕ