Т-клетки памяти
Т-клетки памяти дифференцируются из активированных Т-лимфоци- тов (CD4+ и CD8+) в Т-зонах лимфоидных органов под действием антигена, презентируемого им дендритными клетками (см. рис. 3.123). Т-клетки памяти развиваются несколько позже эффекторных Т-клеток: если пик численности эффекторных CD8+ Т-лимфоцитов приходится на 7-е сутки после инфицирования вирусом, а к 15-м суткам их численность уже снижается, СD8+ Т-клеточная память формируется между 3-й и 4-й неделями. после иммунизации. Эти данные относятся и к CD4+ Т-клеткам памяти. Развитие CD8+ Т-клеток памяти нуждается в помощи CD4+ Т-клеток.
Вопрос о дифференцировке Т-клеток памяти из уже дифференцированных субпопуляций Т-хелперов в настоящее время до конца не решен. Известно, что предшественниками клеток памяти не являются IFNy-продуцирующие клетки (т.е. TM-клетки), в то же время ими могут быть как IL-4-, так и IL4+ CD4+ Т-клетки (т.е. ^2-клетки).
Т-клетки памяти имеют морфологию малых лимфоцитов, но отличаются от наивных Т-клеток многими деталями мембранного фенотипа. От эффекторных Т-клеток они отличаются прежде всего отсутствием функциональной активности — синтеза цитокнов, а CD8+ Т-клетки памяти — еще и отсутствием цитотоксической активности и ее морфологических (цитолитические гранулы) и молекулярно-генетических (экспрессия генов перфорина и гранзима В) проявлений.
Тем не менее, многие свойства сближают Т-клетки памяти с эффектор- ными Т-лимфоцитами (табл. 3.29). При развитии тех и других повышается экспрессия продуктов генов MHC классов I и II, CD2, его лиганда СD58, Р2-интегрина LFA-1 и индуцируется экспрессия Pj-интегринов (в наибольшей степени VLA-4). В то же время степень экспрессии TCR и корецепторов не изменяется. На поверхности наивных Т-клеток в период покоя TCR и корецепторы CD4/CD8 физически не связаны и только при формировании иммунного синапса между ними устанавливается нековалентная связь, благодаря которой TCR перемещается в рафт (см. раздел 3.5.1.3). По некоторым данным, эта связь сохраняется в Т-клетках памяти.
Таблица 3.29. Сравнительная характеристика наивных и активированных Т-лимфо- цитов, плазматических клеток и Т-клеток памяти
|
Клетка |
Молекулы адгезии |
Хемокино- вые рецепторы |
Варианты экспрессируемых молекул СD45 |
Костимули- рующие молекулы |
Другие молекулы активации |
|
Поко ящаяся Т-клетка |
OD62L, LFA-1, CD2 |
CXCR7 |
CD45RA |
CD28 |
Не установлены |
|
Акти вирован- ная Т-клетка |
Ослабление экспрессии CD62L, LFA-1, CD2. Появление VLA-4, ICAM-1 |
ССЯ4, ССЯ6, OOR9, ^R10 |
Последовательный переход на экспрессию CD45RB, CD45RC и CD45R0 |
CD28, CD154, CD152, ICOS |
CD69, CD25, MHC-II, CD71, CD95 |
|
Цент ральная Т-клетка памяти |
CD62L, LFA-1, VLA-1 |
CCR7 |
CD45R0 |
CD28 |
Не установлены |
|
Эффек- торная Т-клетка памяти |
CD44, VLA-4, LFA-1, CD2, р7-интегрины |
^R4, ^R6, ^R9, ^R10, СXCR4 |
CD45R0 |
CD28, ICOS |
MHC-II |
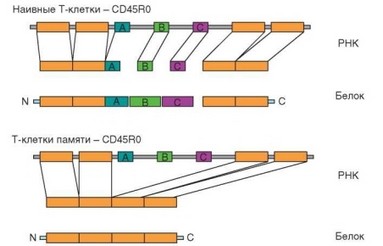
Рис. 3.124. Особенности сплайсинга рибонкулеиновой кислоты и структуры внеклеточной части молекулы CD45R наивных Т-клеток и Т-клеток памяти
Выше уже упоминалось об изменениях структуры молекулы CD45, происходящих при дифференцировке Т-лимфоцитов в эффекторные клетки. Эти особенности молекулы CD45 свойственны также Т-клеткам памяти. Суть изменений состоит в утрате внеклеточных доменов А, В и С и превращении молекулы в укороченный вариант CD45R0, облегчающий активацию клетки (рис. 3.124). Молекула CD45R0 в качестве маркера Т-клеток памяти не очень надежна, поскольку со временем может замещаться исходным вариантом молекулы CD45RA и лишь при повторной стимуляции восстанавливается изоформа CD45R0.
Биологический смысл изменений структуры молекулы CD45 неясен. Есть сведения о том, что формирование иммунного синапса с участием клеток, несущих укороченный вариант молекулы CD45, облегчается за счет устранения помех для взаимодействия клеток, создаваемых протяженной молекулой CD45RA. С этим связывают более быструю и эффективную активацию Т-клеток, несущих укороченный вариант молекулы. Кроме того, установлено, что CD45RA+ T-клетки с большей вероятностью подвергаются апоптозу при действии активирующих стимулов. Устойчивость Т-клеток памяти к апопто- тической гибели повышается также в связи с усиленной экспрессией анти- апоптотических молекул Bcl-2 и Bcl-XL. Эффекторным Т-клеткам вначале тоже свойственна сильная экспресия этих молекул, но затем она ослабляется, что обусловливает их относительно раннюю гибель.
Большое число изменений мембранных молекул, общих для эффек- торных Т-клеток и значительной части Т-клеток памяти (эффекторных Т-клеток памяти), затрагивает свойства, определяющие направление миграции клеток. Прежде всего происходит ослабление экспрессии L-селектина (CD62L), обусловливающее поступление рециркулирующих наивных Т-кле-
ток во вторичные лимфоидные органы. Кроме того, эффекторные клетки перестают экспрессировать хемокиновый рецептор CCR7 — проводник клеток в Т-зоны. Ослабление экспрессии CD62L и утрата CCR7 обусловливает значительное ослабление способности этих клеток мигрировать в Т-зоны вторичных лимфоидных органов. Вместо этого эффекторные Т-клетки, включая Т-клетки памяти, начинают экспрессировать CD44 (распознает гиалуронаты), а также ряд интегринов (р1, р7) и хемокиновых рецепторов, не характерных для наивных Т-клеток. Эти молекулы обусловливают миграцию несущих их клеток в барьерные ткани, а также в очаги воспаления. Хемокиновые рецепторы, экспрессируемые эффекторными Т-клетками памяти, направляют миграцию этих клеток в определенные участки организма: ССR6 — в различные слизистые оболочки, ССR9 — в кишечник, ССR4 и ССR10 — в кожу, CXCR4 — в костный мозг. Кроме того, некоторые из этих рецепторов (CCR4, CCR6) необходимы для миграции Т-клеток памяти в воспаленные ткани.
Однако помимо эффекторных Т-клеток памяти существует другая их разновидность — центральные Т-клетки памяти. Сравнительная характеристика двух вариантов Т-клеток памяти представлена в табл. 3.29. Эти клетки сохраняют молекулы хоминга, свойственные наивным Т-клеткам. Это определяет сохранение центральными Т-клетками памяти способности мигрировать в Т-зоны вторичных лимфоидных органов. Центральные и эффекторные Т-клетки памяти различаются также по скорости мобилизации во вторичный иммунный ответ (она существенно выше у эффекторных). Существует 2 различных взгляда на взаимоотношение этих клеток. Согласно одному из них центральные и эффекторные — 2 разные субпопуляции Т-клеток памяти; согласно другому — это стадии развития Т-клеток памяти (предплагают, что центральные клетки служат предшественниками эффекторных клеток памяти).
Таким образом, эффекторные Т-клетки памяти по своей локализации и путям рециркуляции существенно отличаются от наивных Т-клеток и центральных Т-клеток памяти. Если два последних типа клеток в процессе рециркуляции постоянно возвращаются в Т-зоны вторичных лимфоидных органов (лимфатических узлов, селезенки и пейеровых бляшек), то эффекторные Т-клетки памяти рециркулируют, практически минуя эти органы, и мигрируют в костный мозг и нелимфоидные органы, особенно в барьерные ткани. Эти пути рециркуляции пересекаются в брыжеечных лимфатических узлах, в которые могут проникать как наивные Т-лимфоциты, так и Т-клетки памяти.
Для Т-клеток памяти характерен очень продолжительный срок жизни, сопоставимый со сроком жизни всего организма. Об этом свидетельствует сохранение в течение десятков лет клеток, несущих хромосомные перестройки, индуцированные лучевыми воздействиями. Описано сохранение памяти к антигенам вирусов (обусловлена CD8+ Т-клетками) в течение 75 лет. В настоящее время не вызывает сомнений, что для поддержания длительного персистирования в организме Т-клеток памяти повторные контакты их с антигеном не требуются. Суммарная численность Т-клеток памяти с возрастом постепенно увеличивается, достигая в преклонном возрасте половины всех Т-лимфоцитов. В то же время клональная структура популяции Т-клеток памяти существенно отличается от таковой наивных Т-клеток. Как уже отмечалось, численность клонов наивных Т-лимфоцитов составляет 105—106 клеток, а численность клеток в каждом клоне составляет (1—2)х105. При общей численности Т-клеток памяти, сопоставимой с численностью наивных Т-лимфоци- тов, популяция Т-клеток памяти содержит примерно 103 клонов, т.е. на 2—3 порядка меньше, чем в популяции наивных Т-клеток. Следовательно, число Т-клеток памяти в каждом клоне в 100—500 раз больше, чем в клонах наивных Т-клеток. Уже это обстоятельство свидетельствует о преимуществах вторичного ответа (который начинается с активации клеток памяти) перед первичным.
Репертуар Т-клеток памяти отражает часть антигенраспознающего реперуара лимфоидных клеток организма, который имеет отношение к распознаванию антигенов, реально окружающих данный организм, т.е. «актуальных» антигенов. Реаранжировка V-генов создает случайный анти- генраспознающий репертуар, не учитывающий реальные потребности организма, а процесс селекции вносит в него коррективы, удаляя ненужные (не распознающие молекул MHC) и опасные (аутоспецифические) клоны. Под влиянием прямого воздействия экзогенных антигенов формируется антигенраспознающий репертуар Т-клеток памяти — третий по счету и наиболее адекватный реальным потребностям организма вариант анти- генраспознающего репертуара.
Как уже отмечалось, для поддержания жизнеспособности Т-клеток памяти не требуется участие антигена. Численность Т-клеток памяти определяют 3 процесса:
- выживаемость клеток;
- фоновая пролиферация;
- гомеостатическая пролиферация (направлена на устранение изменений численности клеток, вызванных различными причинами).
Гомеостаз Т-клеток памяти поддерживается по «облегченному» варианту по сравнению с гомеостазом наивных Т-клеток, поскольку потребность в контактном распознавании комплексов молекул MHC с антигенными пептидами клеток памяти минимальна, а контроль осуществляется почти исключительно гомеостатическими цитокинами IL-15 и IL-7 (см. рис. 3.79). Фоновую пролиферацию CD8+ Т-клеток памяти поддерживает IL-15, а CD4+ Т-клеток памяти — IL-7. Те же цитокины служат факторами выживаемости упомянутых клеток, хотя для CD8+ Т-клеток IL-15 может быть заменен на IL-7. Наконец, гомеостатическую пролиферацию CD8+ Т-клеток памяти индуцирует IL-7 и только при индукции гомеостатической пролиферации CD4+ Т-клеток памяти наряду с действием IL-7 требуется распознавание комплексов MHC с пептидными фрагментами аутоантигенов. Постепенное увеличение с возрастом объема популяции Т-клеток памяти в значительной степени связано с увеличением спонтанной выработки IL-15. IL-15 презентируется CD8+ Т-клеткам памяти (как и NK-клеткам) в комплексе с a-цепью его рецептора (IL-15Ra), а распознается димерным рецепторм Ру-рецептором для IL-2/IL-15 промежуточного аффинитета.
Поскольку размер пула Т-клеток памяти для каждого возраста стабилен, возникает проблема его изменения при действии очередного антигена. Так,
при инфицировании патогенами, с которыми организм ранее не контактировал, возникают новые клоны Т-клеток памяти, что должно было бы привести к увеличению объема их популяции. Этого не происходит благодаря феномену сокращения (attrition): все клоны Т-клеток равномерно уменьшают свою численность в соответствии с уровнем гомеостатических цитокинов, а также действием IFNa, ограничивающего фоновую пролиферацию этих клеток.
Сдедует упомянуть еще один источник Т-клеток памяти, обозначаемых как «суррогатные». Массовая гибель Т-лимфоцитов под влиянием повреждающих факторов (облучение, цитотоксические лекарственные средства и т.д.) приводит к запуску гомеостатической пролиферации наивных периферических Т-лимфоцитов. В результате численность Т-клеток восстанавливается, но происходит конверсия мембранного фенотипа Т-клеток: вместо молекул, характерных для наивных Т-клеток, экспрессируются молекулы, свойственные Т-клеткам памяти (рис. 3.125). Вследствие этого образующиеся Т-клетки рециркулируют подобно Т-клеткам памяти. В отличие от естественного процесса дифференцировки Т-клеток памяти, процесс конверсии происходит без предварительной активации Т-клеток и поликлонально. Эти клетки пополняют пул эффекторных Т-клеток памяти. Однако такая поликлональная реакция лишена функциональной целесообразности и имеет отрицательные последствия. Так, эти клетки, не обогащающие
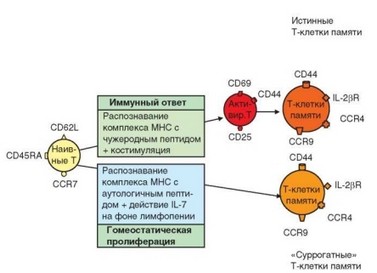
Рис. 3.125. Особенности формирования Т-клеток памяти при иммунном ответе и подобных им (суррогатных) Т-клеток при гомеостатической пролиферации. Классический путь дифференцировки Т-клеток памяти в результате распознавания антигена и активации сопоставлен с формированием поликлональных «суррогатных» Т-клеток в процессе гомеостатической пролиферации, не предусматривающей
контакта с антигеном и активации
антигенраспознающий репертуар «актуальными» клонами, занимают в нишах место, предназначенное для истинных Т-клеток памяти и тем самым сужают объем «полезных» клонов. Другое отрицательное последствие конверсии регенерирующих наивных Т-клеток в Т-клетки памяти состоит в повышении угрозы развития аутоиммунных процессов. К рассмотрению этого вопроса мы вернемся позже (см. раздел 4.4.1.1).
Источник: Ярилин.А.А , «Иммунология » 2010
А так же в разделе «Т-клетки памяти »
- Презентация антигена
- Миграция клеток, участвующих в презентации антигена
- Иммунный синапс
- Костимуляция
- Активация Т-лимфоцитов
- Пролиферативная экспансия клонов Т-хелперов
- Дифференцировка Т-хелперов
- Th17 и другие адаптивные субпопуляции Т-клеток
- ИММУННЫЙ ОТВЕТ
- Клеточный иммунный ответ
- Воспалительный Т-клеточный иммунный ответ
- Гуморальный иммунный ответ
- Активация В-лимфоцитов. Роль Т-клеток и цитокинов
- Дифференцировка и селекция В-клеток в зародышевых центрах
- Гибридомы и моноклональные антитела. Генно-инженерные антитела
- Иммунологическая память и вторичный иммунный ответ
- В-клетки памяти
- Вторичный иммунный ответ
- Неклассические проявления иммунных реакций
- 3.6.4.3. Проявления активности у5Т- и CD8aa+ Т-клеток
- Иммунологические функции NKT-клеток
- Иммунные процессы в слизистых оболочках (мукозальный иммунный ответ)
- Афферентное и центральное звенья мукозального иммунного ответа
- Роль миграции клеток в мукозальном иммунитете
- Эффекторные механизмы мукозального иммунитета
- Контроль и регуляция иммунного ответа
- Генетический контроль иммунного ответа
- Эндокринный и нервный контроль иммунного ответа
- Регуляция иммунного ответа
- Регуляторные Т-клетки
- РЕЗЮМЕ