Регуляция иммунного ответа
Рассмотренные выше контрольные факторы являются внешними по отношению к иммунной системе. Они определяют готовность организма к иммунному ответу, устанавливают его предельные возможности и преобладающую направленность. Иммунорегуляторные факторы порождаются также внутри иммунной системы, как правило, в ходе иммунного ответа. Обычно они клоноспецифичны и направлены на ограничение, сдерживание иммунных процессов.
Важную роль в определении длительности и интенсивности иммунного ответа играет антиген. Его присутствие в организме обусловливает непрерывное вовлечение в иммунный процесс клонов лимфоцитов. После элиминации антигена рекрутирование лимфоцитов прекращается, что служит основной причиной прекращения иммунного ответа. Однако в завершении иммунного процесса важную роль играют активные механизмы, проявление которых заложено в программу развития иммунного ответа. Эти процессы при полном удалении из организма возбудителя и его антигенов значительно ускоряют завершение иммунного ответа и возвращение к исходному состоянию иммунной системы. Включение сдерживающих механизмов, не сопряженное с полной элиминацией антигена, во многом определяет особенности хронических инфекционных и аутоиммунных процессов.
Внутриклеточные механизмы иммуносупрессии. Супрессорные иммунорецепторы
Выше неоднократно упоминалось о супрессорном мотиве ITIM, который служит альтернативой активационному мотиву ITAM и предназначен для передачи в клетку ингибирующих сигналов. Последовательность аминокислот ITIM можно представить в виде формулы: I/V/L/S-X-Y-XX-L, где Y — остатки тирозина, X — любые остатки, а I, V, L, S — остатки гидрофобных аминокислот (изолейцина, валина, лейцина, серина).
Наиболее важное свойство ITIM — способность привлекать (рекрутировать) тирозинфосфатазы SHP1, SHP2, SHIP и т.д., через которые и реализуется ингибирующее действие ITIM. Передача активационных сигналов осуществляется с помощью протеинкиназ. Эти ферменты фосфорилируют белки, что приводит к их активации. Фосфатазы, напротив, дефосфори- лируют белки и тем самым прерывают передачу активационного сигнала. В связи с этим рецепторы, цитоплазматическая часть которых содержит последовательности ITIM, являются супрессорными. К наиболее известным ITIM-содержащим ингибиторным рецепторам относят FcyRIIB (см. далее), ингибирующие рецепторы NK-клеток (NKG2, KIR) и ряд других мембранных молекул.
Наиболее изученный и важный из супрессорных рецепторов Т-клеток — рецептор CTLA-4 (CD152). Это структурный аналог главной костимулиру- ющей молекулы Т-лимфоцитов CD28. Его молекулярная масса составляет 41—43 кДа. Как и CD28, CD152 представляет гомодимер, скрепленный дисульфидной связью. Каждый мономер содержит 1 внеклеточный домен из суперсемейства иммуноглобулинов (тип V). Подобно CD28, CTLA-4 взаимодействует с костимулирующими молекулами CD80 и CD86 АПК, но имеет к ним значительно более высокое сродство, чем CD28. В покоящихся Т-клетках CTLA-4 локализован в цитоплазме, а при активации перемещается на мембрану. Это происходит в поздний период активации Т-клетки, когда она уже получила стимулирующие сигналы, и активация реализовалась. Обычно CTLA-4 экспрессируется на заключительном этапе существования иммунного синапса, «разборке» которого эта молекула способствует.
Цитоплазматическая часть молекулы CTLA-4 не имеет последовательности ITIM, однако в ней содержатся 2 остатка тирозина в позициях 165 и 182. Из них для передачи супрессорных сигналов наиболее важен остаток 165, поскольку с ним взаимодействуют некоторые ферменты — липидная киназа PI3K, и две фосфатазы — SHP2 и PP2A (для проявления супрессорного эффекта особенно важна последняя), а также адапторные белки АР-1 и АР-2, участвующие в перемещении молекулы CTLA в цитоплазму и обратно (рис. 3.136). Супрессорное действие CTLA-4 объясняют конкуренцией с CD28 за связывание молекул CD80/CD86. В результате передача в клетку активирующих сигналов прекращается, и в нее поступают ингибирующие сигналы. В реализацию супрессорного эффекта сигналов, поступающих через CTLA-4, вносят вклад и другие механизмы:
- повышение порога стимуляции выработки цитокинов;
- подавление экспрессии транскрипционных факторов (NFkB, NF-AT и AP-1);
- активация 2,3 иоксигеназы индоламина (ингибирует активность лимфоцитов в результате истощения пула триптофана);
- усиление подвижности Т-клеток и модуляция состава рафтов (укорачивает срок существования иммунного синапса);
- индукция выработки супрессорного цитокина TGFp и дифференци- ровка регуляторных Т-клеток.
Известны единичные активационные эффекты CTLA-4 (например, активация киназы JNK), которые могут проявиться только при особых условиях связывания CTLA-4. В целом же появление на поверхности Т-клетки CTLA-4 и связывание этой молекулы с лигандами (В7 — CD80/CD86) приводит к ослаблению или прекращению активации Т-клетки вследствие действия внутриклеточных фосфатаз PP2A и SHP2. Эти фосфатазы прерывают
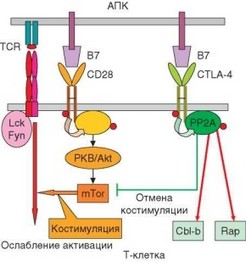
Рис. 3.136. Пути передачи внутриклеточных супрессорных сигналов. В зависимости от того, взаимодействует молекула В7 с CD28 или CTLA-4, в клетку поступает кос- тимулирующий или ингибирующий сигнал
поступление в клетку активационного сигнала, дефосфорилируя сигнальные белки.
Среди мембранных молекул — гомологов костимулирующей молекулы CD28 — существует еще по крайней мере 2 рецептора, передающие в Т-клетки ингибирующий сигнал. Это PD-1 (Programmed death-1) и BTLA (B- and Т-lymphocyte attenuator). В отличие от CTLA-4, эти рецепторы содержат в своей цитоплазматичсекой части последовательность ITIM. Передача супрессорных сигналов происходит благодаря привлечению к этим мотивам фосфатаз SHP1 и SHP2.
Изотипическая регуляция гуморального иммунного ответа и супрессорные Fc-рецепторы
Один из основных механизмов регуляции гуморального иммунного ответа основан на изменении баланса в организме антигена и антител. Накапливающиеся антитела связывают антиген, что приводит к образованию иммунных комплексов. В состав иммунных комплексов входят антитела различных классов, причем в начальном периоде ответа преобладают иммунные комплексы, содержащие IgM-антитела, а в более позднем периоде — IgG-содержащие комплексы. В зависимости от избытка антигена или антител состав комплексов бывает различным (см. раздел 3.2.1.4). В начальный период преобладает антиген, и Fc-участки антител могут быть экранированы молекулами антигена. При этом эпитопы антигена доступны для лимфоцитов, а иммуногенность антигена в составе иммунного комплекса повышается. Таким образом, «ранние» иммунные комплексы
способствуют дальнейшему развитию иммунного ответа. В более поздний период в иммунном комплексе преобладают антитела, и их Fc-участок экспонирован на поверхности комплекса.
Таким образом, в позднем периоде иммунного ответа создаются условия, благоприятные для распознавания иммунных комплексов, содержащих IgG-антитела. Распознавание осуществляют Fc-рецепторы как фагоцитов (что важно для поглощения чужеродных клеток, опсонизированных антителами), так и В-лимфоцитов. Последнее имеет прямое отношение к регуляции иммунитета, поскольку на их поверхности присутствуют рецепторы типа FcyRIIB, имеющие в цитоплазматической части последовательность ITIM.
Введение IgG-антител мышам за 1—2 сут до их иммунизации антигеном, к которому эти антитела специфичны, приводит к ослаблению гуморального иммунного ответа. При этом угнетается формирование клеток, продуцирующих антитела (как IgG, так и IgM). На секрецию антител уже сформировавшимися плазматическими клетками IgG-антитела не влияют. Наоборот, систематическое удаление антител в ходе иммунного ответа вызывает рост числа антителообразующих клеток и усиление секреции антител. Fab- и F(ab’)2-фрагменты антител и содержащие их иммунные комплексы, а также IgG-антитела иной специфичности ингибирующим действием не обладают. Таким образом, ингибирующее действие свободных IgG-антител и их комплексов с антигеном на выработку антител зависит от присутствия в их молекулах Fc-участка, а также от специфичности их активного центра, которая должна соответствовать специфичности подавляемых антител.
Анализ механизмов подавления IgG-антителами образования антител В-лимфоцитами показал, что для его реализации необходимо формирование комплексов с молекулами антигена. Необходимо, чтобы при связывании иммунного комплекса произошло перекрестное сшивание Fc-рецептора и рецептора BCR за счет взаимодействия с Fc-частью молекулы антитела и эпитопом в составе антигена соответственно. Связывание с BCR обеспечивает специфичность действия иммунного комплекса на клон В-лимфо- цитов, вовлеченный в иммунный ответ, а связывание с Fc-рецептором — реализацию ингибирующего эффекта. Формирование В-клеток памяти, а также активность специфических Т-хелперов при этом не изменяется.
Этот тип подавления гуморального иммунного ответа реализуется через Fc-рецепторы определенного типа — FcyRIIB, локализованные на B-лимфоцитах и содержащие в своей цитоплазматической части последовательность ITIM. Вовлечение в реакцию BCR обеспечивает активацию связанных с рецептором Sre-тирозинкиназ Lck, Fyn, Lyn и Blk, которые осуществляют фосфорилирование остатка тирозина. Это, в свою очередь, необходимо для рекрутирования фосфатаз SHP1, SHP2, SHIP, которые осуществляют дефосфорилирование белков (в том числе сигнальных) и прерывают передачу активационных сигналов (рис. 3.137).
Идиотипическая регуляция иммунного ответа
Идиотип — это характеристика антител, обусловленная уникальной структурой активного центра, выявляемой с помощью антител к идиотопу — эпитопу, структурно связанному с активным центром антитела (см. раздел 3.1.1.3). Различают индивидуальные и перекрестно реагирующие идио-
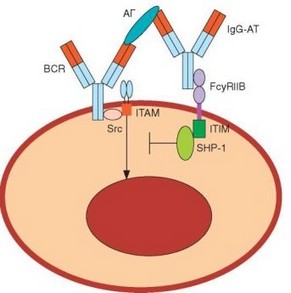
Рис. 3.137. Изотипическая регуляция образования антител, реализуемая через FcyRII. Антиген, связавшийся с В-клеточным рецептором, одновременно формирует комплекс с растворимыми IgG-антителами. Комплекс распознается FcyRII-рецептором, передающим в В-клетку супрессорный сигнал
типы. Индивидуальные идиотипы уникальны и могут рассматриваться как маркеры определенной специфичности антител у конкретных индивидов. Перекрестнореагирующие идиотипы характерны для антител к распространенным антигенам. Такие антитела образуются в разных, но генетически родственных организмах. При близком структурном совпадении идиотопа с активным центром антител антигенсвязывающий участок антиидиотипи- ческих антител может выступать в качестве «суррогатного» антигена, или «внутреннего образа антигена».
В соответствии с концепцией идиотипической сети, сформулированной Н. Йерне (N. Jerne), в организме существует равновесие между идиотипами (в том числе антителами к чужеродным антигенам) и антиидиотипами (в том числе этими антигенами). Поступление экзогенного антигена (анти- идиотипа) вызывает сдвиг этого равновесия, восстанавливаемого синтезом антител (идиотипа, антител 1-го порядка). На пике иммунного ответа равновесие вновь нарушается, но уже в противоположном направлении — вследствие накопления избыточных количеств антител. Система восстанавливает равновесие, синтезируя антиидиотипические антитела (антитела 2-го порядка). Ситуация повторяется пока равновесие не стабилизируется. При близком соответствии эпитопов антигена и антиидиотипа реакцией на избыток антител 2-го порядка будет образование не новых антител (3-го
порядка), а антител 1-го порядка. Динамика системы при этом ограничивается взаимодействием двух составляющих — антигена/антиидиотипа и антитела/идиотипа.
В действительности структура идиотипа практически никогда точно не совпадает со структурой активного центра антитела. Поэтому в описанной схеме структура антител очередного уровня все меньше отражает структуру эпитопов и активных центров исходной пары реагирующих молекул; колебания их соотношений затухают. Тем не менее, описанная схема в определенной степени соответствует реальности (удается выявить образование антидиотипических и даже анти-антиидиотипических антител) и находит отражение в механизмах регуляции иммунного ответа.
Роль перекрестно реагирующих идиотипов в регуляции иммунного ответа состоит в ограничении выработки несущих идиотоп антител анти- идиотипическими антителами (в данном случае срабатывает FcR-зависимый механизм подавления антителообразования). Так, введение мышам линии C57BL/6, иммунизированным фосфорилхолином, антител к идиотипу Т15 вызывает значительное снижение гуморального ответа на фосфорилхолин за счет подавления образования Т15+-антител. Роль частных (индивидуальных) идиотипов, маркрирующих продукты отдельных клонов В-клеток, в регуляции образования антител состоит в ограничении вклада этого клона в иммунный ответ. Это проявляется сменой доминирующих клонов антителопродуцентов, которую удается зарегистрировать экспериментально.
Супрессорные цитокины
Широко известно взаимно ингибирующее действие цитокинов, вырабатываемых Т-хелперами одного типа, на образование цитокинов Т-хел- перами другого типа (например, Th1-цитокины подавляют образование ^2-цитокинов; и Th1- и ^2-цитокины ингибируют синтез ТЫ7-цито- кинов). Понятие «супрессорный цитокин» относят к более ограниченной группе цитокинов, для которых характерно преобладание ингибирующих эффектов над стимулирующими. Наиболее известны 2 таких цитокина — TGFp и IL-10. Оба эти цитокина вносят существенный вклад в ограничение иммунного ответа, причем их эффект не является клоноспецифическим.
IL-10 описан как ингибитор активности ТЫ-клеток. Его молекулярная масса составляет 35—40 кДа. Он является прототипом семейства цитокинов, в которое входят IL-19, IL-20, IL-22, IL-24, IL-26. У мышей IL-10 вырабатывают ^2-клетки (у человека — также ТЫ-клетки), некоторые типы регуляторных Т-клеток, цитотоксические Т-лимфоциты, моноциты/макрофаги, дендритные и тучные клетки, В1-лимфоциты. Разнообразные гомологи IL-10, частично воспроизводящие его функции, вырабатываются вирусами. Рецепторы IL-10 — димеры, образованные полипептидными цепями а и в, с которыми связаны цитоплазматические тирозинкиназы (соответственно, Jak1 и Tyk2). В передаче сигнала принимают участие транскрипционные факторы STAT1, STAT3, а в моноцитах — также STAT5.
Основной эффект IL-10 — противовоспалительный. Он реализуется через подавление активности макрофагов и Т-лимфоцитов (особенно Th1 и Th17) —прежде всего синтеза этими клетками провоспалительных цитокинов. Будучи антагонистом IFNy, IL-10 подавляет экспрессию молекул
MHC-II, а также пролиферацию активированных Т-лимфоцитов, развитие воспалительной формы иммунного ответа и гиперчувствительности замедленного типа. В то же время в тимусе он выступает в качестве кофактора IL-7 и IL-2 в поддержании пролиферации тимоцитов. IL-10 способствует развитию гуморального иммунного ответа; он служит синергистом IL-4 при действии на В-клетки, защищая их от апоптоза, усиливая их пролиферацию, дифференцировку в антителообразующие клетки, синтез ими IgM и IgA. Этот цитокин участвует также в антипаразитарной защите.
Таким образом, IL-10 выступает в роли ^2-цитокина, способствуя реализации гуморальных иммунных реакций и выступая в качестве супрессорного цитокина в отношении воспалительных процессов и адаптивных иммунных реакций клеточного типа. Представители семейства IL-10 при структурном сходстве существенно различаются по функциям. IL-24 представляет особый интерес в связи со способностью избирательно вызывать апоптоз опухолевых клеток.
Трансформирующий фактор роста в (TGFP) описан в 1981 г. в составе группы ростовых факторов. Свое название он получил в связи со способностью индуцировать «трансформированный» фенотип у нормальных клеток, растущих в культуре (потеря контактного торможения, отделение от субстрата, реорганизация цитоскелета). Он представляет собой гомодимер (молекулярная масса — 25 кДа). Продуцентами TGFp служит огромное число клеток, включая стромальные, эпителиальные клетки, макрофаги, регуляторные Т-лимфоциты, многие разновидности опухолевых клеток. Он секретируется в неактивной форме: требуется протеолитическое расщепление молекулы, чтобы она приобрела способность взаимодействовать с высокоаффинными рецепторами. Последние содержат 2 цепи. Связывание цитокина приводит к активации киназной активности внутриклеточного домена цепи TGFpRII, вследствие чего происходят олигомеризация и фосфорилирование цепей I и II и активация транскрипционных факторов Smad2 и Smad3, а также запуск Smad-независимых путей активации клетки.
Мишенями фактора служат также очень многие виды клеток, экспрессирующие высокоаффинный рецептор TGFp. При действии TGFp на иммунную систему преобладают ингибирующие эффекты. Он подавляет синтез воспалительных цитокинов, ответ Т-лимфоцитов на ростовые цитокины, дифференцировку цитотоксических Т-лимфоцитов, активность естественных киллеров. В то же время TGFp способствует развитию незрелых моноцитов, мобилизации нейтрофилов и моноцитов в очаг воспаления. Он усиливает синтез белков межклеточного матрикса, ускоряет заживление ран, оказывает анаболический эффект. TGFp способствует переключению синтеза антител на изотип IgA и усиливает синтез этого иммуноглобулина на посттранскрипционном уровне, тем самым способствуя защите слизистых оболочек. TGFp — фактор, необходимый для развития провоспалительных Thn-клеток и супрессорных естественных регуляторных Т-клеток. Являясь продуктом естественных и адаптивных регуляторных Т-клеток, он отвечает за реализацию многих их эффектов. Выключение гена TGFp обусловливает развитие генерализованной воспалительной патологии с гиперплазией лимфоидной ткани в кишечнике в сочетании с системными аутоиммунными процессами.
Таким образом, TGFp — важный супрессорный цитокин, подавляющий преимущественно воспалительные процессы и связанные с ними формы Т-клеточного иммунного ответа. Он служит важным регулятором системы иммунитета, предотвращающим аутоиммунные процессы. В то же время TGFp способствует развитию воспалительных клеток и реализации начальных этапов воспалительного процесса, а также регенерации тканей.
Источник: Ярилин.А.А , «Иммунология » 2010
А так же в разделе «Регуляция иммунного ответа »
- Презентация антигена
- Миграция клеток, участвующих в презентации антигена
- Иммунный синапс
- Костимуляция
- Активация Т-лимфоцитов
- Пролиферативная экспансия клонов Т-хелперов
- Дифференцировка Т-хелперов
- Th17 и другие адаптивные субпопуляции Т-клеток
- ИММУННЫЙ ОТВЕТ
- Клеточный иммунный ответ
- Воспалительный Т-клеточный иммунный ответ
- Гуморальный иммунный ответ
- Активация В-лимфоцитов. Роль Т-клеток и цитокинов
- Дифференцировка и селекция В-клеток в зародышевых центрах
- Гибридомы и моноклональные антитела. Генно-инженерные антитела
- Иммунологическая память и вторичный иммунный ответ
- В-клетки памяти
- Т-клетки памяти
- Вторичный иммунный ответ
- Неклассические проявления иммунных реакций
- 3.6.4.3. Проявления активности у5Т- и CD8aa+ Т-клеток
- Иммунологические функции NKT-клеток
- Иммунные процессы в слизистых оболочках (мукозальный иммунный ответ)
- Афферентное и центральное звенья мукозального иммунного ответа
- Роль миграции клеток в мукозальном иммунитете
- Эффекторные механизмы мукозального иммунитета
- Контроль и регуляция иммунного ответа
- Генетический контроль иммунного ответа
- Эндокринный и нервный контроль иммунного ответа
- Регуляторные Т-клетки
- РЕЗЮМЕ