Роль миграции клеток в мукозальном иммунитете
Роль направленной миграции лимфоцитов в функционировании мукозального иммунитета особенно велика. Все разновидности эффекторных Т-клеток, сформировавшихся в региональном лимфатическом узле, покидают
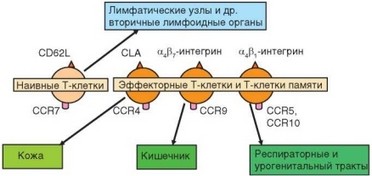
Рис. 3.130. Зависимость путей миграции наивных и эффекторных Т-клеток от экспрессии молекул адгезии и хемокиновых рецепторов. Символы над рядом клеток — молекулы адгезии; под ним — хемокиновые рецепторы
его с эфферентной лимфой и в составе лимфы грудного протока поступают в общий кровоток. Дальнейшее распределение эффекторных Т-клеток определяется экспрессией ими молекул адгезии и хемокиновых рецепторов (рис. 3.130). Эти клетки способны мигрировать предпочтительно в лимфоидные ткани, ассоциированные со слизистыми оболочками, преимущественно в отделы, из которых происходят индуцировавшие их дендритные клетки.
Активированные Т-клетки попадают в эпителиальный пласт и lamina propria через плоский эпителий сосудов. Функцию «проводников» этих клеток через сосудистую стенку в эпителиальный слой слизистых оболочек выполняют интегрины Pj (VLA-4 — а4РР и р7 (aEP7 и аф7) (табл. 3.31). При этом интег- рины аф4 и аЕР7 обеспечивают поступление лимфоцитов в любые слизистые оболочки, тогда как интегрин аф7 в определенной степени специфичен для Т-клеток, мигрирующих в тонкий кишечник. Такая избирательная миграция связана с распределением рецепторов упомянутых интегринов. Если рецепторы для интегринов аф4 (молекула VCAM-1) и aEP4 (Е-селектин) содержатся на эндотелиальных клетках сосудов всех типов слизистых оболочек, то рецептор для интегрина a4P7 (MadCAM) присутствует преимущественно в сосудах кишечника (на клетках как высокого, так и плоского эндотелия). Интегрин аЕР7 взаимодействует также с Е-кадхерином эпителиальных клеток кишечника, что способствует удержанию мигрировавших Т-клеток в эпителии.
Таблица 3.31. Молекулы адгезии и хемокины, ответственные за миграцию лимфоцитов в лимфоидной ткани, ассоциированной со слизистыми оболочками
|
Клетки |
Молекулы адгезии* |
Хемокины** |
|
Наивные Т-клетки |
CD62L — PNAd, GfyCAM; LFA-1 — ICAM-1 |
CCR7 — CCL19, CCL21 |
|
Наивные В-клетки |
CD62L — PNAd, GfyCAM; LFA-1 — ICAM-1 |
CXCR5 — CXCL13 |
Окончание табл. 3.31
|
Клетки |
Молекулы адгезии* |
Хемокины** |
|
Эффекторные Т-клетки и эффекторные Т-клетки памяти |
LFA-1 — ICAM-1; VLA-4 — VCAM-1; аБР7-интегрин — Е-кадхерин, а4р7-интегрины — MadCAM1 |
CCR5 — CCL5; CCR10 — CCL28. При воспалении: CCR2 — CCL2 CCR3 — CCL9, CCL10, CCL11 |
|
IgA+ В-клетки памяти |
LFA-1 — ICAM-1; VLA-4 — VCAM-1 |
CCR10 — CCL28 |
* В каждой паре слева — молекулы поверхности лимфоцитов, справа — молекулы поверхности эндотелиальных/эпителиальных клеток.
** В каждой паре слева — рецептор, экспрессируемый лимфоцитами, справа — хемокин, секретируемый стромальными клетками
Набор хемокинов, определяющий направление миграции эффекторных лимфоцитов, отличается от такового для наивных клеток. Для миграции лимфоцитов в слизистую оболочку тонкого кишечника необходима экспрессия на них рецептора CCR9, распознающего хемокин CCL25 (ТЕСК). Для миграции в слизистые оболочки респираторного и урогенитального трактов такого однозначного «проводника» не выявлено, но установлена значимость нескольких хемокинов и их рецепторов. Важную роль в привлечении Т-клеток в эпителий слизистых оболочек, включая слизистые дыхательных путей, играет хемокин CCL5 (RANTES), спонтанно вырабатываемый стромальными клетками легких и распознаваемый рецептором CCR5 поверхности эффекторных лимфоцитов и Т-клеток. Другая пара молекул (хемокин и его рецептор), которая участвует в привлечении эффекторных лимфоцитов и клеток памяти в слизистые оболочки — CCL28 (МЕС) и CCR10. Есть также данные о роли хемокинов CCL11 (эотаксина), CCL17 (TARC), ССL1 (I-309) и распознающих их рецепторов CCR3, CCR4 и CCR8 в привлечении эффекторных CD4+Г-клеток в слизистые оболочки. Миграция лимфоцитов в слизистые оболочки усиливается при воспалительной реакции, когда происходит активация эндотелия ^судов мукозальной лимфоидной ткани. При этом усиливается экспрессия на клетках эндотелия молекул адгезии ICAM-1, VCAM-1 (рецепторы интегринов), MadCAM и Р-селектина. Одновременно происходит усиление выработки хемокинов, в частности ССL5 (RANTES) и CCL2 (MCP-1). Эти молекулы привлекают лимфоциты, несущие рецепторы CCR5 и CCR2. Два типа хоминга лимфоцитов обусловливают существование двух автономных кругов рециркуляции, пересекающихся в брыжеечных лимфатических узлах.
Внутриэпителиальные лимфоциты не способны возвращаться в рециркуляцию. Они заканчивают свой жизненный цикл в результате апоптоза внутри слизистой или в просвете органа, куда они способны мигрировать. Для слизистой оболочки бронхов показано, что базоапикальная миграция Т-клеток обусловлена взаимодействием молекулы LFA-1 поверхности лимфоцита с молекулой ICAM-1 окружающих клеток. Важную роль в миграции играют также Ргинтегрин VLA-4 и компоненты межклеточного матрикса, служащие его рецепторами. Направление движения определяется градиентом хемокина CCL5 (RANTES).
Именно рециркуляция лимфоцитов с характерными для них механизмами хоминга и хемотаксиса обеспечивает целостность единой системы мукозального иммунитета и эффективность ее работы при иммунном ответе. В основе способности эффекторных Т-лимфоцитов и Т-клеток памяти «находить» отдел слизистых оболочек, в котором произошел захват антигена дендритными клетками, лежит механизм импринтинга. Этот процесс обусловлен особенностями дендритных клеток, «запечатленными» при захвате антигена в разных участках лимфоидных тканей слизистых оболочек. Определяющая роль в формировании импринтинга четко показана для дендритных клеток пейеровых бляшек. При презентации антигена Т-клеткам они индуцируют экспрессию на формирующихся затем эффекторных Т-лимфоцитах и Т-клетках памяти молекул адгезии и хемокиновых рецепторов, обеспечивающих их миграцию в соответствующие участки барьерных тканей. Достаточно четко (хотя и не абсолютно) детерминирована миграция клеток в кишечный отдел мукозальной лимфоидной ткани. В то же время механизм импринтинга не дифференцирует респираторный и урогенитальный тракты. Так, поступление антигена через слизистые оболочки бронхов инициирует образование эффекторных лимфоцитов и клеток памяти, мигрирующих в равной степени в респираторный и урогенитальный тракты и существенно слабее — в кишечник и кожу. Лимфоциты, активированные дендритными клетками кишечника, интенсивно мигрируют в кишечник, несколько слабее — в другие отделы лимфоидных тканей слизистых оболочек и практически не мигрируют в кожу. Показано, что при захвате антигена в кишечнике в дендритных клетках образуется ретиноевая кислота. Она определяет экспрессию на Т-лимфоцитах, активированных этими дендритными клетками, а4Р7-интегрина и хемокинового рецептора CCR9, направляющих их миграцию в кишечник.
В принципе аналогичным способом обеспечивается «прицельность» миграции в слизистые оболочки эффекторных В-клеток — предшественников антителопродуцентов и В-клеток памяти. Уже упоминалось о высоком проценте IgA+ В-клеток памяти в мукозальной лимфоидной ткани. Тропность IgA+ В-клеток к слизистым оболочкам обусловлена присутствием на них рецепторов CCR10 и CCR9, распознающих хемокины CCL28 и CCL25 соответственно. Эти хемокины вырабатываются стромальными клетками лимфоидной ткани, ассоциированной со слизистыми оболочками. Выработка CCL28 неодинакова в различных отделах мукозальных лимфоидных тканей и коррелирует со степенью бактериальной контаминации. Она высока в кишечном и носоглоточном отделах и существенно ниже в лимфоидной ткани, ассоциированной со слизистой оболочкой бронхов, что определяет различное содержание в них IgA+ В-клеток. Среди молекул адгезии основную роль в миграции IgA+ В-клеток играют интегрин а4р1 и его рецептор VCAM-1. Однако преобладание IgA+ В-клеток среди антителопродуцентов обеспечивается также локальной дифференцировкой В-клеток в IgA-продуценты в лимфоидных тканях слизистых оболочек.
Таким образом, благодаря тонко скоординированному процессу избирательной миграции эффекторных лимфоцитов и клеток памяти достигается адекватность доставки эффекторных клеток в места проникновения патогена, индуцировавшего иммунный процесс. Не всегда эффекторные клетки мигрируют в места запуска иммунного процесса. Они могут попадать в другие участки лимфоидных тканей, ассоциированных со слизистыми оболочками, особенно воспаленные. Благодаря этим «преднамеренным ошибкам» достигается морфофункциональное единство мукозальной лимфоидной ткани.
Источник: Ярилин.А.А , «Иммунология » 2010
А так же в разделе «Роль миграции клеток в мукозальном иммунитете »
- Презентация антигена
- Миграция клеток, участвующих в презентации антигена
- Иммунный синапс
- Костимуляция
- Активация Т-лимфоцитов
- Пролиферативная экспансия клонов Т-хелперов
- Дифференцировка Т-хелперов
- Th17 и другие адаптивные субпопуляции Т-клеток
- ИММУННЫЙ ОТВЕТ
- Клеточный иммунный ответ
- Воспалительный Т-клеточный иммунный ответ
- Гуморальный иммунный ответ
- Активация В-лимфоцитов. Роль Т-клеток и цитокинов
- Дифференцировка и селекция В-клеток в зародышевых центрах
- Гибридомы и моноклональные антитела. Генно-инженерные антитела
- Иммунологическая память и вторичный иммунный ответ
- В-клетки памяти
- Т-клетки памяти
- Вторичный иммунный ответ
- Неклассические проявления иммунных реакций
- 3.6.4.3. Проявления активности у5Т- и CD8aa+ Т-клеток
- Иммунологические функции NKT-клеток
- Иммунные процессы в слизистых оболочках (мукозальный иммунный ответ)
- Афферентное и центральное звенья мукозального иммунного ответа
- Эффекторные механизмы мукозального иммунитета
- Контроль и регуляция иммунного ответа
- Генетический контроль иммунного ответа
- Эндокринный и нервный контроль иммунного ответа
- Регуляция иммунного ответа
- Регуляторные Т-клетки
- РЕЗЮМЕ