Дифференцировка и селекция В-клеток в зародышевых центрах
Судьба активированных В-клеток и эффективность их дифференциров- ки зависит от того, мигрируют ли они в зародышевые центры или поступают в мозговые шнуры, минуя эти фолликулярные структуры (рис. 3.117). В процессе дифференцировки на большинстве В-лимфоцитов экспрессируется хемокиновый рецептор CXCR5, распознающий а-хемокин CCL13 (BLC). Этот хемокин синтезируется в лимфоидных фолликулах и привлекает активированные В-лимфоциты в зародышевые центры, формирующиеся в фолликулах при гуморальном иммунном ответе. CXCR5- В-клетки не способны мигрировать в первичные фолликулы и остаются в межфолликулярном пространстве, а затем мигрируют в мякотные шнуры, где происходит их дифференцировка в IgM-образующие клетки при минимальном участии Т-лимфоцитов. Изотип и аффинитет антител, секретируемых этими клетками, остается неизменным. Эти клетки отличаются коротким сроком жизни (3—5 сут). CXCR5+ В-клетки, при активации антигеном приобретающие способность мигрировать в первичные фолликулы, проходят путь Т-зависимой дифференцировки в зародышевом центре с участием фолликулярных дендритных клеток и Т-лимфоцитов (CD4+ фолликулярных T-хелперов — TFH). В этих В-клетках происходит переключение изотипов и «созревание» аффинитета. Они дифференцируются в долгоживущие антителообразующие клетки. Этот путь развития для антителообразующих клеток является основным и будет рассмотрен подробнее.
При рассмотрении строения вторичных лимфоидных органов мы упоминали о первичных фолликулах — основных морфологических структу-
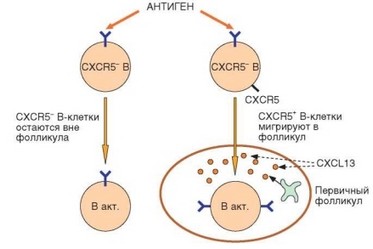
Рис. 3.117. Различные пути развития антителообразующих клеток в зависимости от способности В-клеток мигрировать в фолликулы. В зависимости от экспрессии хемокинового рецептора CXCR5, В-клетки или мигрируют в первичный фолликул, или оказываются вне его. В первом случае, распознав антиген, В-лимфоциты проходят все стадии развития (включая переключение изотипов и созревание аффинитета) в антителообразующие клетки с продолжительным сроком жизни. Вне фолликулов В-клетки дифференцируются в короткоживущие IgM-продуценты
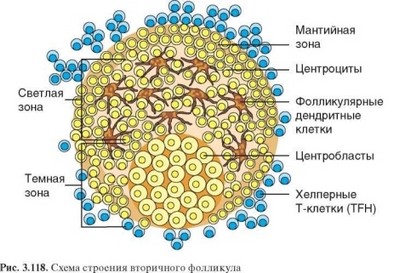
рах, свойственных различным лимфоидным органам и служащих местом локализации наивных В-клеток. В ходе иммунного ответа в фолликулах формируются зародышевые центры, или центры размножения; при этом В-клетки первичного фолликула оттесняются на периферию зародышевого центра, образуя его мантию. Фолликулы, в которых сформировался зародышевый центр , называют вторичными. Зародышевые центры имеют яйцевидную форму; в них выделяют апикальную и базальную зоны, а в последней — светлую (верхняя) и темную (нижняя) зоны (рис. 3.118).
Морфогенез зародышевых центров осуществляется под влиянием мембранного гетеродимера лимфотоксина аф2 лимфоцитов при активном участии фолликулярных дендритных клеток, экспрессирующих мембранные рецепторы к лимфотоксину р. Фолликулярные дендритные клетки происходят из местных мезенхимальных клеток-предшественников и их родство с обычными дендритными клетками вызывает сомнение. Именно фолликулярным дендритным клеткам принадлежит ключевая морфогенетическая роль в развитии зародышевых центров: при нокауте генов лимфотоксинов эти клетки не дифференцируются и формирования зародышевых центров не происходит. Фолликулярные дендритные клетки секретируют хемокин CXCL13, который привлекает В- и Т-лимфоциты, несущие хемокиновые рецепторы CXCR5. Другая особенность этих клеток состоит в экспрессии
Fcy-рецепторов, способных связывать иммунные комплексы. Уже говорилось, что в зародышевые центры мигрирует большинство активированных В-клеток. В последнее время возникло представление о существовании особой разновидности Т-лимфоцитов — фолликулярных Т-хелперов (T^-клеток). T^-лимфоциты — активированные CD4+ Т-хелперы, основными особенностями которых, помимо упомянутой экспрессии хемокино- вого рецептора CXCR5, является экспрессия транскрипционного фактора В^6 и секреция цитокина IL-21.
В-лимфоциты, связавшие антиген и получившие дополнительные сигналы от Т-клеток в перифолликулярном пространстве, мигрируют в зародышевый центр. Здесь они вовлекаются в 2 процесса, играющих важную роль в обеспечении «высокого качества» конечных продуктов гуморального иммунного ответа — антител. Активированные клетки проникают в зародышевый центр через базальную темную зону и перемещаются до апикальной зоны (рис. 3.119). В зародышевом центре они трансформируются в бласты (центробласты) и интенсивно делятся, чему способствует экспрессия внутриклеточного фактора Bcl-6. На поверхности центроб- ластов исходно присутствует IgM, в то время как IgD экспрессирован слабо или отсутствует. Одновременно с делением происходит переключение изотипов Н-цепей иммуноглобулинов. Молекулярно-генетические аспекты переключения изотипов рассмотрены в разделе 3.1.4.3. Этот процесс реализуется при обязательном участии Т-лимфоцитов под влиянием двух групп сигналов. Контактные сигналы передаются в В-клетку через ко- стимулирующие молекулы CD40 и ICOS. Эта передача сигнала отвечает за включение процесса. Выбор С-гена конкретной Н-цепи происходит под влиянием эпигенетических влияний, регулируемых цитокинами. Уже отме-
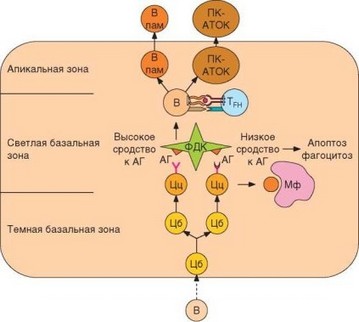
Рис. 3.119. Селекция В-лимфоцитов и дифференцировка антителопр оду центов и В-клеток памяти в зародышевом центре. В темной базальной зоне зародышевых центров происходит усилением мутагенеза в V-генах пролиферирующих центро- бластов (Цб). В светлых базальных зонах осуществялется отбор В-центроцитов (Цц) с наиболее высоким сродством к антигену (АГ); клетки, не поддержанные селекцией, подвергаются апоптозу и фагоцитируются макрофагами (МФ). В апикальной зоне В-клетки, получившие сигнал от фолликулярных Т-хелперов (TFH), дифференцируются в плазматические клетки и В-клетки памяти. Детали см. в тексте
чалось (см. рис. 3.19), что у мышей IL-4 отвечает за переключение изотипов на у4 и е, IFNy — на у2а и у3, TGFp — на а и y2b. У человека эффекты цитокинов определяют не столь однозначно. Тем не менее можно назвать доминирующие эффекты цитокинов: IL-4 индуцирует переключение на у4 и е; IFNy — на у1 и, возможно, у3; TNFp — на а1 и а2 и, возможно, у2
(в переключении на изотип у1 участвует также IL-21). Действие цитокинов продолжается на посттранскрипционном уровне. IL-10 стимулирует запуск синтеза антител практически всех классов. IL-6 усиливает синтез IgM и IgG1, IL-5 стимулирует выработку IgA, а IL-13 — образование IgE. Перечисленные цитокины действуют на различных уровнях — одни из них усиливают процесс трансляции, другие поддерживают пролиферацию В-лимфоцитов и незрелых плазматических клеток. Для переключения изотипов необходима также экспрессия гена AID, играющего ключевую роль в другом процессе — гипермутагенезе F-генов.
Ген AID (Activation-induced cytidine deaminase) экспрессируется в делящихся центробластах. Кодируемый им фермент осуществляет дезаминирование остатков цитидина в одноцепочечной ДНК до дезоксиуридина. В норме AID играет важную роль в сохранении целостности генома и репарации ДНК после эксцизии измененных оснований. В зародышевых центрах AID катализирует замены оснований, приводящие к резкому повышению частоты соматических мутаций (см. раздел 3.1.4.2). Степень повышения частоты мутаций очень высока: она составляет 4—5 порядков (до 10-2—10-3 при исходной частоте 10-6—10-8). Мутации имеют точечный характер и относятся к трансцизиям (т.е. превращаениям внутри одного класса нуклеотидов — пуриновых или пиримидиновых). Повышение частоты мутаций происходит практически исключительно в V-гене, особенно в его участке CDR3, соответствующем области соединения зародышевого V-гена с сегментами D и J (см. раздел 3.1.4.1). Одновременно в В-клетках происходит ослабление экспрессии антиапопто- тического фактора Bcl-2, что повышает риск развития апоптоза.
Миграция В-клеток в светлую базальную зону совпадает с прекращением деления и усиленного мутагенеза. В-центробласты уменьшаются в размере и превращаются в В-центроциты. На молекулярном уровне этому соответствует ослабление экспрессии внутриклеточного фактора Bcl-6 и начало экспрессии фактора Blimp-1, обеспечивающего дифференци- ровку В-центроцитов в плазматические клетки. В светлой зоне В-центро- циты отбираются по высокому сродству их BCR к антигену (см. рис. 3.119). В результате гипермутационного процесса образуются В-клетки, несущие множество вариантов исходного иммуноглобулинового рецептора. В подавляющем большинстве случаев мутации нарушают сродство активного центра рецептора к антигену, однако неизбежно возникают варианты с более высоким сродством.
Назначение селекции состоит в отборе В-клеток, несущих BCR с максимальным сродством к антигену. Как уже упоминалось, фолликулярные дендритные клетки экспрессируют на поверхности Fcy-рецепторы, которые связывают иммунные комплексы. В таком виде чужеродные антигены способны очень долго сохраняться в зародышевых центрах. Количество антигена, фиксированного на фолликулярных дендритных клетках, ограничено. Это обусловливает конкуренцию В-лимфоцитов за связывание с этим антигеном. Связывание антигена служит источником сигнала к выживанию, который приводит к усилению экспрессии фактора Bcl-2 и тем самым предотвращает развитие апоптоза. Связывание антигена сопровождается установлением контактов между В-центробластами и фолликулярными дендритными клетками. При этом происходит взаимодействие ряда мембранных молекул, в частности CD21 (на В-клетке) и CD23 (на фолликулярной дендритной клетке). Это взаимодействие повышает эффективность распознавания антигена и снижает риск развития апоптоза В-клетки в 100 раз. В-центроциты, не связавшие антиген в силу более низкой аффинности их BCR, подвергаются апоптозу и фагоцитируются макрофагами.
Дополнительный сигнал, поддерживающий жизнеспособность В-клетки, получают также при контакте с фолликулярными T-хелперами при условии предварительного связывания В-клеткой антигена и презентации его фрагмента Т-клетке (т.е. при этом повторяется процесс, происходящий при получении
В-клеткой хелперного сигнала в межфолликулярном пространстве). Источником поддерживающего сигнала со стороны Т-клеток является взаимодействие молекул CD154 и CD40 (сигнал в В-клетку подается через молекулу CD40).
В результате в зародышевых центрах происходит переключение класса мембранных иммуноглобулинов и повышение их сродства к антигенным эпитопам. Эти эффекты взаимосвязаны, поскольку повышение афинности мембранных иммуноглобулинов невозможно при сохранении исходного изотипа — IgM. Аффинность IgG-антител при первичном иммунном ответе возрастает примерно в 100 раз: если исходная величина Kd как для IgM, так и для IgG составляет исходно около 10-6 М, то в ходе первичного иммунного ответа Kd IgG-антител достигает 10-8—10-9 М, тогда как для IgM-антител эта величина практически не меняется. При вторичном иммунном ответе происходит дополнительный, очень существенный рост аффинитета IgG-антител. Другой аспект «повышения качества» гуморального иммунного ответа состоит в том, что антитела класса IgG более действенны как эффекторные молекулы, чем IgM-антитела. Это обусловлено тем, что к IgG-антителам на поверхности эффекторных клеток врожденного иммунитета есть рецепторы (FeyR), тогда как Fcii-рецепторов не существует. Важно отметить, что иммуноглобулины, составляющие основу мембранных рецепторов, служат прообразом антител, которые секретируются плазматическими клетками — потомками В-лимфоцитов, участвующих в иммунном ответе. Следовательно, миграция активированных В-клеток в зародышевые центры служит обязательным условием развития высокоэффективного гуморального иммунного ответа.
- Дифференцировка плазматических клеток и секреция антител
При переходе в апикальную зону В-клетки вновь делятся и дифференцируются в двух направлениях — в плазматические (антителообразующие) клетки и В-клетки памяти (табл. 3.28).
Таблица 3.28. Сравнительная характеристика наивных и активированных В-лимфо- цитов, плазматических клеток и В-клеток памяти
|
Клетка |
Морфология |
Локализация |
Иммуногло булины |
Мембранные маркеры |
|
Поко ящаяся наивная В-клетка |
Малый лимфоцит |
Лимфоидные фолликулы, наружные слои коры узлов, маргинальная зона и т.д. |
Мембранные IgM и IgD |
CD19, CD20, CD21, CD22, CD72, CD81, CD40, CD45, MHC-II, CXCR5 |
|
Активированный В- лимфоцит |
Лимфобласт |
Зародышевые центры, мякотные шнуры |
Мембранный IgM; переключение изотипов |
CD19, CD20, CD21, CD22, CD72, CD81, CD40, CD45, MHC-II, CXCR5, CD25, CD69, CD126, CXCR4 и т.д. Внутриклеточно — AID, Bel-6 |
Окончание табл. 3.28
|
Клетка |
Морфология |
Локализация |
Иммуногло булины |
Мембранные маркеры |
|
Плазмати ческая клетка |
Крупная клетка с базофильной цитоплазмой и развитым эндоплазматическим ретикулумом |
Костный мозг, красная пульпа селезенки, мякот- ные шнуры |
Цитоплазматические и секретируе- мые Ig любого класса |
CXCR4, CD138, LFA-1, CD44. Внутриклеточно — Blimp-1 |
|
В-клетка памяти |
Малый лимфоцит |
Lamina propria слизистых оболочек, дерма, костный мозг |
Мембранные IgG, IgA, реже IgE |
CD19, CD20, CD21, CD22, CD40, CD45, CD72, MHC-II, ICAM-1, CXCR4 |
В апикальной части зародышевого центра образуются плазмобласты (см. рис. 3.119). Они еще сохраняют способность к пролиферации, причем в качестве ростового фактора для них выступает IL-6. Плазмобласты подвижны, экспрессируют на поверхности молекулы MHC. В то же время они утрачивают хемокиновый рецептор CXCR5 и приобретают рецептор CXCR4, что позволяет им покинуть зародышевый центр. Полагают, что эмиграция из зародышевых центров клеток, которым предстоит секретировать антитела, необходима, чтобы предотвратить нейтрализацию антителами антигена, сохраняемого на фолликулярных дендритных клетках. Вначале плазмобласты мигрируют в мозговые шнуры лимфатических узлов, маргинальные зоны и красную пульпу селезенки, где они дифференцируются в зрелые плазматические клетки. Еще находясь на стадии плазмобластов, будущие продуценты антител покидают лимфатические узлы и селезенку. В конечном счете большинство этих клеток попадает в костный мозг (40—45%) и слизистые оболочки, преимущественно кишечника (33—35%). Во вторичных лимфоидных органах остается меньше 25% антителообразующих клеток (7—8% в селезенке и 15—17% в лимфатических узлах). В слизистых оболочках плазмоциты локализуются в lamina propria и подслизистом слое, в коже — в дерме.
Зрелые плазматические клетки полностью утрачивают подвижность, а также способность реагировать практически на все внешние стимулы. Это обусловлено потерей характерных для В-клеток мембранных молекул — иммуноглобулинов и других компонентов BCR, молекул MHC, костимулиру- ющих молекул. Наиболее характерный мембранный маркер плазмоцитов — белок синдикан (CD138), участвующий во взаимодействии плазматических и стромальных клеток. Дифференцировка плазматических клеток обусловлена утратой экспрессии ответственного за пролиферацию фактора Blc-6 и дифференцировочного фактора В-клеток Pax-5, а также экспрессией дифференцировочного фактора Blimp-1. Помимо других факторов этому способствует IL-21, секретируемый фолликулярными Т-клетками.
Плазматические клетки имеют большой размер (20 мкм и более). Для ядра этих клеток характерна периферическая конденсация хроматина. Цитоплазма характеризуется большим объемом, базофилией и сильно развитым аппаратом синтеза белка (разветвленный эндоплазматический ретикулум, рибосомы, аппарат Гольджи). Цитоплазма имеет максимальный объем на стадии незрелой плазматической клетки, которая еще сохраняет способность к делению. Зрелые плазмоциты представляют собой образец высокоспециализированных клеток. До 50% матричной РНК в зрелых плазматических клетках кодирует иммуноглобулин, на долю которого приходится около 30% синтезируемого белка.
Каждая плазматическая клетка синтезирует и секретирует антитела одного изотипа, аллотипа, идиотипа и одной специфичности. Все эти характеристики совпадают со свойствами мембранного иммуноглоулина В-клетки предшественницы плазмоцита (рис. 3.120). При образовании растворимых форм иммуноглобулинов/антител плазмоциты вместо мембранной синтезируют свободную молекулу иммуноглобулина. Механизм этого переключения рассмотрен выше (см. раздел 3.1.4.4). Оно состоит в удалении (путем сплайсинга) из молекулы матричной РНК, кодирующей Н-цепь, экзонов МС, ответственных за синтез мембранного домена молекулы, и экспрессии экзона SQ кодирующего С-концевую часть растворимой молекулы иммуноглобулина.
Синтез полипептидных цепей антител происходит в полисомах, связанных с шероховатым эндоплазматическим ретикулумом. Сборка мономерной молекулы происходит по одному из двух путей. Первый из них состоит в
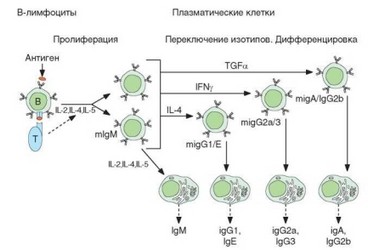
Рис. 3.120. Дифференцировка антителообразующих (плазматических) клеток. Проиллюстрировано переключение изотипов, реализуемое на уровне рецепторов В-клеток при участии цитокинов. Результат — секреция антител различных изотипов
димеризации Н-цепей с последовательным подсоединением к Н-димеру двух L-цепей:
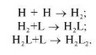
Второй путь начинается с образования димера Н- и L-цепей; затем два таких димера объединяются и формируется «зрелая» молекула иммуноглобулина:
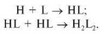
Первый вариант характерен для синтеза IgG, второй — для синтеза IgM. Растворимая форма иммуноглобулина не способна встраиваться в мембрану; молекула поступает из эндоплазматического ретикулума в аппарат Гольджи, где подвергается процессингу, гликозилированию, переходит в секреторные везикулы и секретируется.
При первичном иммунном ответе вначале секретируются IgM-антитела. У мышей возрастание числа клеток, секретирующих эти антитела, регистрируют уже на 2-е сутки после внутрибрюшинного введения антигена. Пик их содержания в селезенке приходится на 4-е сутки, а после 5-х суток их уровень быстро сокращается. IgG-антителообразующие клетки выявляют в селезенке, начиная с 4-х суток, их число достигает максимума на 8—10-е сутки, а последующая убыль происходит медленнее, чем снижение числа IgM-продуцентов. Титры сывороточных антител имеют сходную динамику, но с некоторой задержкой: пик IgM-антител выявляют на 5—6-е, а IgG-антител — на 10—12-е сутки. Высокое содержание сывороточных IgG-антител сохраняется до 20-25-х суток, а затем оно медленно снижается в течение 2—3 мес. Антитела класса IgG, точнее субкласса IgG1, доминируют среди сывороточных иммуноглобулинов, особенно при вторичном иммунном ответе. Во вторичных лимфоидных органах вне барьерных тканей 55—66% образуемых антител приходится на долю IgG, 11—30% — на долю IgA и 15—23% — на долю IgM. Сывороточные IgA- и IgE-антитела в целом повторяют кинетику антител класса IgG. В слизистых оболочках преобладает синтез и секреция антител класса IgA (до 90% от всех секретируемых иммуноглобулинов).
Долгое время не удавалось объяснить пожизненное сохранение достаточно высокого уровня антител, индуцированного вакцинацией против некоторых патогенов (описана продолжительность жизни плазматической клетки, секретирующей антивирусные антитела, в 75 лет). Длительность жизни антителообразующих клеток, индуцированных in vitro или выделенных из организма после индукции in vivo, невелика — она составляет 5—7 сут. Таков же срок жизни антителообразующих клеток, сформировавшихся в неоптимальных условиях (например, не прошедшх через зародышевые центры — см. выше). Продолжительность жизни плазматических клеток в лимфатических узлах и селезенке обычно составляет 4—7 нед. Она значительно удлиняется в костном мозгу, где плазматические клетки
могут сохраняться десятки лет — срок, сопоставимый с продолжительностью жизни человека. Длительное выживание плазматических клеток поддерживается контактными взаимодействиями со стромальными клетками, особенно при участии молекул CD138, CD44, в2-интегрина LFA-1, селекти- нов Е и Р, при действии цитокинов — IL-6, IL-21, IL-5, TNFa и особенно хемокина CXCL12 (SDF-1), узнаваемого рецептором CXCR4. Имеет значение и длительное поддержание экспрессии внутриклеточных факторов — Bcl-1, Blimp-1 и т.д. Миграция плазматических клеток в очаги воспаления (при экспрессии хемокинового рецептора CXCR3) также способствует длительному выживанию плазматических клеток, поддерживаемому стромальными клетками в очаге воспаления. Считают, что долгоживущими становится 10—20% плазматических клеток.
- Эффекторные функции антител
Участие антител в реализации иммунной защиты может осуществляться как путем прямого действия на молекулы или организмы (носители антигенов), так и косвенно, путем привлечения дополнительных эффекторных механизмов (комплемент, фагоциты) (рис. 3.121).
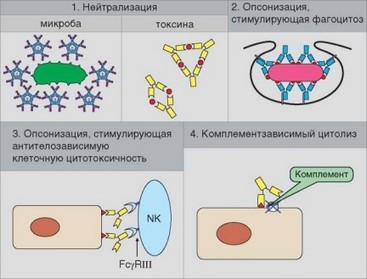
Рис. 3.121. Основные механизмы действия антител. Нейтрализующее действие антител (вариант 1) проиллюстрировано на примере IgM-антител, блокирующих микроорганизм и IgG-антител, формирующих иммунный комплекс с токсином. Варианты 2 и 3 (опсонизация, усиливающая фагоцитоз, и стимуляция цитотоксической активности NK-клеток) реализуются через взаимодействие иммуноглобулинов с Fcy-рецепторами клеток. Взаимодействие с антигеном (вариант 4) открывает комп- лементсвязывающие участки IgG-антител, что приводит к запуску комплемента по классическому пути и лизис или опсонизацию клетки-мишени
Нейтрализующее и блокирующее действие антител
Лучше всего изучены 2 механизма прямой реализации защитной функции антител — нейтрализация токсинов и поверхностная блокада патогенов. Экзотоксины — основные факторы патогенности ряда микроорганизмов (например, возбудителей дизентерии, столбняка, ботулизма, газовой гангрены). Нейтрализация наиболее эффективна, если функциональная группа токсина одновременно служит эпитопом или пространственно перекрывается с ним. На нейтрализующей способности антител основана серотерапия и серопрофилактика дифтерии, бешенства, заболеваний, вызываемых анаэробными бактериями. Блокада нейтрализующими антителами поверхности вирусов препятствует инфицированию ими клеток. Нейтрализация антигенов — основная функция антител субклассов IgG2 и IgG4, слабо связывающих комплемент и не взаимодействующих с Fc-рецепторами фагоцитов.
Блокирующая активность антител связана с нарушением функций мембранных структур патогенов, с которыми взаимодействуют антитела, или которые пространственно экранируются ими. Общеизвестным проявлением такого действия является обездвиживание бактерий при взаимодействии антител с антигенами жгутиков или иных структур, отвечающих за подвижность клетки. Блокирующий эффект составляет основу действия IgA-антител, особенно секреторных (см. раздел 3.6.5.5). Их активность проявляется, главным образом, в полости кишечника или других трактов. Взаимодействуя с антигенами поверхности микроорганизмов, антитела не только нарушают их подвижность, но и препятствуют их адгезии на поверхности эпителиальных клеток слизистых оболочек, тем самым предотвращая колонизацию эпителиального покрова и проникновение патогенов через эпителиальный барьер во внутреннюю среду организма.
Защитная активность антител, опосредованная связыванием комплемента
Значительно больше востребован другой механизм проявления защитной активности антител. Формируя иммунный комплекс с антигенами поверхности чужеродных клеток (прежде всего патогенов), антитела изменяют свою конформацию таким образом, что при этом демаскируются участки доменов CH2 и CH3, экранированные в интактной молекуле антитела L-цепями. Это обеспечивает связывание с иммунным комплексом сывороточной молекулы C1q, что приводит к каскадной активации комплемента по классическому пути (см. раздел 2.5.1.3) и реализации двух эффекторных иммунных механизмов. Один из них связан с опсонизацией — отложением на поверхности клетки-мишени избыточного количества фрагментов C3b. При дальнейшем расщеплении эти фрагменты превращаются в iC3b и C3d, распознаваемые С3-рецепторами фагоцитирующих клеток, что обеспечивает поглощение и разрушение ими патогена. Второй механизм обусловлен литическим действием комплемента: последовательное вовлечение в реакцию «поздних» компонентов комплемента завершается формированием (с преимущественным участием фактора С9) в мембране клетки-мишени поры, нарушающей целостность клеточной стенки микроорганизма и приводящей к его гибели. Комплементсвязывающая способность в наибольшей степени свойственна антителам классов IgM, IgG1 и IgG3 (в связи с высоким сродством их Fc-доменов к C1q). Как уже отмечалось (см. раздел 2.5.1.7), вклад прямого литического действия комплемента в его суммарный защитный эффект невелик и оно распространяется на ограниченный круг микроорганизмов, прежде всего нейссерий. Дефицит С3 и других, более ранних компонентов комплемента имеет больше проявлений в виде различных иммунодефицитов, что свидетельствует о важной роли опсонизирующего действия комплемента.
Защитное действие антител, опосредованное привлечением эффекторных клеток
Способность Fc-рецепторов различных клеток, прежде всего фагоцитов, распознавать участки в доменах СН2 и СН3 молекул IgG-антител в составе иммунных комплексов имеет многообразное отражение в норме и при патологии. Антитела в составе растворимых иммунных комплексов распознаются Fc-рецепторами, что обеспечивает их поглощение (эндоци- тоз) и последующее расщепление внутри клеток. Элиминацию растворимых иммунных комплексов осуществляют преимущественно макрофаги. Это очень важная функция, поскольку накопление растворимых комплексов, способных взаимодействовать с самыми разнообразными клетками и откладываться в различных тканях, привлекая воспалительные клетки, приводит к развитию патологии (см. раздел 4.5.2.2).
Антитела, связывающиеся с молекулами поверхности патогенов или иных чужеродных клеток, сами по себе, без комплемента, оказывают опсо- низирующее действие, так как распознаются Fc-рецепторами фагоцитов и тем самым облегчают фагоцитоз. Опсонизирующей активностью в наибольшей степени обладают антитела изотипов IgG1 и IgG3. По опсонизирующей активности антитела несколько уступают компонентам комплемента, но часто эти факторы окладываются на поверхности клетки одновременно, что обеспечивает максимальную эффективность опсонизации. Суммирование эффектов двух опсонизирующих агентов (антител и компонентов комплемента) наглядно иллюстрируют результаты экспериментов по оценке выживаемости микроорганизмов in vitro после введения в систему сначала антител, а затем комплемента: каждый из этих факторов снижает выживаемость на 2 порядка.
Выше рассматривалось клеточное распределение различных типов Fc-рецепторов (см. раздел 2.3.4.2). Они широко представлены на всех фагоцитирующих клетках, но богаче всего ими макрофаги, которые экспрессируют все три основные типа рецепторов, (в том числе FcyRI, способный связывать свободные, не входящие в иммунный комплекс антитела). На этом основан особый механизм вовлечения антител в реализацию эффекторных функций макрофагов. Свободные антитела фиксируются FcyRI на их поверхности. При накоплении в тканевой жидкости больших количеств антител к определенным патогенам (при инфицировании) макрофаги могут удерживать на своей поверхности большое число молекул антител одной специфичности. Это обеспечивает специфическое распознавание патогена макрофагами, которые сами по себе не способны осуществлять антигенспецифическое распознавание. Такие макрофаги называют армированными. Им приписывают очень высокую антимикробную активность; in vitro они проявляют также противоопухолевую активность.
К опсонизирующим эффектам можно отнести способность антител, прикрепленных к клеткам-мишеням (опухолевым, аллогенным), облегчать реализацию клеточного (контактного) цитолиза NK-клетками. И в этом случае наибольшую активность проявляют антитела изотипов IgG1 и IgG3 — в соответствии с их наибольшим сродством к рецептору FcyRIII, экспрессируемому естественными киллерами. Распознавание фиксированных антител облегчает узнавание киллером клетки-мишени. Этот вариант цитотоксической реакции называют антителозависимым клеточноопосредованным цитолизом. Для реализации этого цитолиза требуется не особая разновидность NK-клеток (как считали ранее), а экспрессия на поверхности NK-клеток рецептора FcyRIII, т.е. молекулы CD16. Это характерно для субпопуляции естественных киллеров с фенотипом CD56loCD16+, преобладающей в циркуляции. Этот же механизм цитолиза используют другие клетки, не являющиеся «профессиональными» контактными киллерами, например, нейтрофилы и макрофаги.
Таким образом, как и клеточные факторы адаптивного иммунитета, антитела реализуют свое защитное действие, преимущественно привлекая факторы врожденного иммунитета — фагоциты, естественные киллеры, компоненты комплемента. При этом они существенно повышают их эффективность и придают их действию прицельность.
Источник: Ярилин.А.А , «Иммунология » 2010
А так же в разделе «Дифференцировка и селекция В-клеток в зародышевых центрах »
- Презентация антигена
- Миграция клеток, участвующих в презентации антигена
- Иммунный синапс
- Костимуляция
- Активация Т-лимфоцитов
- Пролиферативная экспансия клонов Т-хелперов
- Дифференцировка Т-хелперов
- Th17 и другие адаптивные субпопуляции Т-клеток
- ИММУННЫЙ ОТВЕТ
- Клеточный иммунный ответ
- Воспалительный Т-клеточный иммунный ответ
- Гуморальный иммунный ответ
- Активация В-лимфоцитов. Роль Т-клеток и цитокинов
- Гибридомы и моноклональные антитела. Генно-инженерные антитела
- Иммунологическая память и вторичный иммунный ответ
- В-клетки памяти
- Т-клетки памяти
- Вторичный иммунный ответ
- Неклассические проявления иммунных реакций
- 3.6.4.3. Проявления активности у5Т- и CD8aa+ Т-клеток
- Иммунологические функции NKT-клеток
- Иммунные процессы в слизистых оболочках (мукозальный иммунный ответ)
- Афферентное и центральное звенья мукозального иммунного ответа
- Роль миграции клеток в мукозальном иммунитете
- Эффекторные механизмы мукозального иммунитета
- Контроль и регуляция иммунного ответа
- Генетический контроль иммунного ответа
- Эндокринный и нервный контроль иммунного ответа
- Регуляция иммунного ответа
- Регуляторные Т-клетки
- РЕЗЮМЕ