Генетический контроль иммунного ответа
С помощью технологии отключения (нокаута) генов показано, что для реализации иммунного ответа необходимо функционирование большого числа генов. О том же свидетельствуют данные оценки экспрессии генов при активации клеток иммунной системы — в этом процессе участвуют сотни генов. Генетический контроль в более узком смысле подразумевает возможность варьирования выраженности различных звеньев иммунного ответа в зависимости от аллельных форм тех или иных генов. Наибольшее внимание уделяют двум направлениям изучения генетического контроля иммунных процессов — анализу генетических основ контроля иммунного ответа безотносительно к его специфичности и в зависимости от специфичности вызывающих его антигенов.
Исследования в первом направлении крайне немногочисленны. В этом русле проведены работы по выведению линий мышей с высоким и низким уровнем отвечаемости на антигены (линии Biozzi). Они были получены путем инбридинга мышей с высоким или низким уровнем гуморального иммунного ответа на эритроциты барана. Такой отбор привел к созданию линий с различной конституцией иммунной системы, причем оппозитный уровень иммунного ответа наблюдали при иммунизации не только эритроцитами барана, но и многими другими антигенами, включая тимусне- зависимые (например, бактериальные эндотоксины). В формирование этих альтернативных типов иммунореактивности оказалось вовлечено более 10 генов, в том числе С-гены иммуноглоублинов и некоторые гены, контролирующие активность макрофагов. У мышей этих линий с уровнем антителообразования коррелирует концентрация сывороточных ^М и IgG, степень ее нарастания при иммунном ответе и интенсивность пролиферативного ответа В-лимфоцитов на стимуляцию митогенами и антигенами. В то же время не найдено соответствия уровня гуморального иммунного ответа мышей этих линий и различных характеристик Т-лимфоцитов. В отношении макрофагов были получены неожиданные данные: высокому уровню иммунного ответа соответствовала способность макрофагов подавлять размножение фагоцитированных листерий, но в то же время — низкая способность презентировать антигены Т-хелперам. Высокая резистентность к инфицированию сальмонеллами и листериями сочеталась с низким уровнем антителообразования. Вероятно, в данном случае проявляется оппозит- ный характер Th1- и ^2-зависимых форм иммунного ответа.
Значительно полнее разработана вторая линия исследований — изучение генетической детерминации уровня иммунного ответа на конкретные антигенные эпитопы. Главные результаты в этой области получены при изучении ответа мышей и морских свинок различных линий на синтетические пептиды с известной структурой эпитопов. Примером
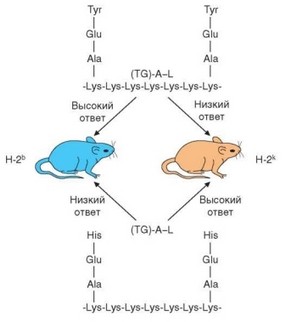
Рис. 3.133. Уровень гуморального иммунного ответа на синтетические пептиды детерминирован генами MHC (у мышей — Н-2). Структурно сходные пептиды индуцируют гуморальный иммунный ответ при оппозитном по направленности контроле со стороны молекул MHC-II
таких результатов могут служить данные о линейных различиях уровня ответа на два синтетических полипептида — (TG)—A—L и (HG) — A — L (см. раздел 3.2.1.3). Оказалось, что генетический контроль иммунного ответа индивидуален для каждого антигена. Контрастным характером ответа отличаются мыши линий C57BL/6 (H-2b) и CBA (H-2k): первые сильно отвечают на (TG)—A—L и слабо — на (HG)—A—L, вторые (CBA) — наоборот (рис. 3.133). Уровень иммунного ответа на названные антигены контролирует один ген, первоначально обозначенный как Ir-1 (Immune response 1). Аллель, детерминирующий высокий уровень ответа, является доминантным. Ген Ir-1 оказался сцепленным с генетическим комплексом MHC, точнее локализуется в области генов MHC класса II. Позже была установлена идентичность гена Ir-1 генам H-2I у мышей. Это подтверждают данные о том, что мутация, затрагивающая экзон гена H-2I-A, кодирующий аминокислотную последовательность в вариабельной области молекулы I-A, приводит к смене высокой отвечаемости на низкую.
Дальнейший анализ показал, что действие гена реализуется на уровне АПК, экспрессирующих молекулы MHC-II. Его механизм состоит в различной способности антигенных пептидов (Т-эпитопов) встраивать
ся в антигенсвязывающую щель в молекуле MHC-II. Хорошее встраивание соответствует высокому уровню отвечаемости, плохое встраивание — низкому. Таким образом, среди многочисленных событий, составляющих иммунный ответ, ключевым для детерминации его количественных показателей является этап презентации антигенного эпитопа Т-хел- перу. Эффективность презентации зависит от степени соответствия между конфигурациями иммунодоминантного эпитопа и антигенсвязывающе- го желобка молекулы MHC-II, свойственной реагирующему организму. Так, у мышей C57BL/6 этот желобок в составе молекулы Н-2ь имеет конфигурацию, в которую хорошо встраивается эпитоп молекулы (TG)—A—L и плохо встраивается эпитоп молекулы (HG)—A—L. Соответствующая полость в составе молекулы Н-2к мышей СВА имеет большее сродство к (HG)—A—L, чем к (TG)—A—L. Понятен и доминантный характер высокого уровня отвечаемости: для успешной презентации антигена достаточно экспрессии одного подходящего типа молекул MHC-II и на эффективность связывания им антигенного пептида не оказывает влияния аллельная молекула MHC-II, плохо связывающая пептид.
Ir-1/MHC-II — основной, но не единственный локус, определяющий уровень иммунного ответа. Описаны локализованные в других участках MHC гены, определяющие уровень ответа (практически всегда — через влияние на презентацию антигена). К генам иммунного ответа относят гены, контролирующие процессинг антигенов, например LMP и ТАР (оба они также расположены в регионе II комплекса MHC). Гены группы LMP кодируют компоненты протеасом, в которых происходит расщепление белков на пептиды, встраивающиеся в молекулы MHC-I, а гены группы ТАР — компоненты транспортной системы, перемещающей эти пептиды из цитозоля в эндоплазматический ретикулум. Регуляция уровня иммунного ответа этими генами обусловлена сродством их продуктов к соответствующим белкам или пептидам и, следовательно, полнотой выполнения ими функций (расщепления, транспорта) и в конечном счете эффективностью доставки пептидов к молекулам MHC-I. Сродство пептидов к антигенсвязывающей щели молекулы MHC-I также служит одним из факторов генетической детерминации уровня ответа, в частности против вирусов (рис. 3.134).
У человека связь генетического контроля иммунного ответа с генами MHC класса II (HLA-DR, HLA-DQ, HLA-DP) четко проявляется при аутоиммунных заболеваниях, развитие которых (т.е. развитие иммунного ответа на аутоантигены) четко контролируют названные гены (подробнее см. раздел 4.4.1.2). На этой связи основана проблема «HLA и иммунозависимые болезни». У людей с определенным генотипом величины относительного риска развития аутоиммунных заболеваний (отношение частоты развития заболевания у носителей данного аллеля и у лиц, не имеющих его) бывают повышены (равны 10—20). В отдельных случаях они значительно выше, достигая 208 при анкилозирующем спондилартрите (связь с аллелем HLA- В27 у ориентов). Доказательством реальности этой связи являются результаты переноса (трансфекции) мышам человеческого гена В27, который приводит к развитию у этих мышей патологии, сходной с анкилозирующим спондилартритом. Проявление эффекта гена (пенетрантность) зависит от ряда обстоятельств, в том числе генетического фона: у людей различных
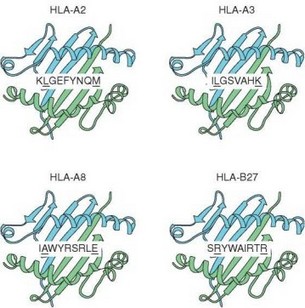
Рис. 3.134. Сродство пептидов вируса гриппа к аллельным вариантам молекул главного комплекса гистосовместимости I класса (MHC-I). В разные аллельные варианты молекулы MHC-I встраиваются различные пептиды белка NP вируса гриппа, распознаваемые CD8+ Т-клетками, что определяет специфичность иммунного ответа
этнических групп величина относительного риска развития заболевания при наличии аллеля В27 варьирует. Молекулярная основа подобных ассоциаций понятна — она также сводится к сродству пептидных эпитопов аутоантигенов с антигенсвязывающей полостью молекулы HLA (в рассмотренном случае — I класса).
Очевидно, что MHC-зависимый генетический контроль уровня иммунного ответа распространяется также на регуляцию устойчивости к инфекциям. Предпочтительная презентация на конкретных аллельных продуктах MHC пептидных фрагментов возбудителей инфекционных заболеваний служит предпосылкой отрицательной связи данного заболевания с наличием соответствующего аллеля. Так, пептиды вируса гриппа с наибольшим сродством встраиваются в молекулы HLA-B27 и HLA^2, в результате чего носители названных аллелей и особенно гаплотипа А2В27 оказываются устойчивыми к гриппу. В то же время преимущественное встраивание в молекулы HLA-B8 и HLA-DR3 аутоантигенных пептидов из белков щитовидной и поджелудочной желез обусловливает наличие положительной корреляции заболеваемости базедовой болезнью, тиреоидитом Хашимото и ювенильным сахарным диабетом с наличием этих аллелей.
Показана роль в контроле уровня иммунного ответа локуса IGH, детерминирующего не только структуру константных доменов иммуноглобулинов, но и некоторые перекрестно-реагирующие идиотипы, связанные с синтезом антител определенной специфичности. С этим генетическим локусом связан контроль уровня гуморального ответа на а(1-3)-декстран, а также IgE-ответа на некоторые аллергены. В случаях МНС-сцепленного контроля он не всегда реализуется через гены МНС: так, предрасположенность к аутоиммунному синдрому новозеландских мышей линии BW1 реализуется через ген TNF.
Генетическая детерминация иммунного ответа не ограничивается контролем его уровня. Генетические факторы определяют также качественные показатели иммунного ответа, в частности, преобладание Th1- и ТИ2-зависимых процессов. Впервые это было четко показано на линейных мышах. У мышей линии BALB/c преобладают ^2-зависимые процессы. У них максимально выражен гуморальный иммунный ответ. Мыши линии C57BL/6 склонны развивать иммунный ответ клеточного типа с преобладанием хелперов Thl-типа. Гены, контролирующие ^1/^2-направленность иммунного ответа, не сцеплены с MHC. Детально изучена генетика аллергического (^2-зависимого) ответа (атопии). Установлено, что наибольшее число генов атопии у человека локализовано в хромосомах 5 и 6 (в хромосоме 5 расположен кластер цитокиновых генов, в том числе генов IL4, IL5, IL3, IL13, IL9, GMCSFи т.д., а в хромосоме 6 — комплекс MHC, контролирующий уровень иммунного ответа). Среди генов, отвечающих за предрасположенность к аллергии, выявлены гены, кодирующие цитокины, способствующие развитию аллергии немедленного типа (IL-4, IL-5, IL-13), гены транскрипционных факторов ^2-клеток (STAT6, GATA-3) и ряд других.
Источник: Ярилин.А.А , «Иммунология » 2010
А так же в разделе «Генетический контроль иммунного ответа »
- Презентация антигена
- Миграция клеток, участвующих в презентации антигена
- Иммунный синапс
- Костимуляция
- Активация Т-лимфоцитов
- Пролиферативная экспансия клонов Т-хелперов
- Дифференцировка Т-хелперов
- Th17 и другие адаптивные субпопуляции Т-клеток
- ИММУННЫЙ ОТВЕТ
- Клеточный иммунный ответ
- Воспалительный Т-клеточный иммунный ответ
- Гуморальный иммунный ответ
- Активация В-лимфоцитов. Роль Т-клеток и цитокинов
- Дифференцировка и селекция В-клеток в зародышевых центрах
- Гибридомы и моноклональные антитела. Генно-инженерные антитела
- Иммунологическая память и вторичный иммунный ответ
- В-клетки памяти
- Т-клетки памяти
- Вторичный иммунный ответ
- Неклассические проявления иммунных реакций
- 3.6.4.3. Проявления активности у5Т- и CD8aa+ Т-клеток
- Иммунологические функции NKT-клеток
- Иммунные процессы в слизистых оболочках (мукозальный иммунный ответ)
- Афферентное и центральное звенья мукозального иммунного ответа
- Роль миграции клеток в мукозальном иммунитете
- Эффекторные механизмы мукозального иммунитета
- Контроль и регуляция иммунного ответа
- Эндокринный и нервный контроль иммунного ответа
- Регуляция иммунного ответа
- Регуляторные Т-клетки
- РЕЗЮМЕ