Основным принципом оценки результатов комплексного исследования иммунного статуса у больного является количественное и функциональное определение всех его звеньев — гуморального, клеточного и неспецифической резистентности — и их сравнение с нормальными величинами. Используя методы клинической иммунологии, необходимо выявить у больного уровень нарушений, а затем осуществлять контроль за восстановлением иммунного статуса организма в процессе лечения. Наиболее часто встречающимся нарушением состояния иммунной системы у человека являются иммунодефициты. Термином «иммунодефициты» обозначают нарушения нормального иммунологического статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа. Различают первичные и вторичные иммунодефициты. В качестве первичных выделены такие состояния, при которых нарушение иммунных механизмов (продукция иммуноглобулинов и/или Т-лимфоцитов) часто связано с генетическим блоком. В зависимости от уровня нарушений и локализации дефекта различают следующие иммунодефициты: гуморальные, клеточные, иммунодефициты, обусловленные дефектами неспецифической системы резистентности (в частности, системы фагоцитоза), и комбинированные.
Недостаточность гуморального иммунитета может проявляться в форме общей гипогам- маглобулинемии как дефекта синтеза иммуноглобулинов, недостаточности антител вследствие общей потери белка (при нефротическом синдроме, экссудативных процессах), вследствие усиления процессов распада иммуноглобулинов. Редко может встречаться селективный дефицит различных иммуноглобулинов. Например, при селективных дефицитах IgG отмечают рецидивирующие инфекции верхних дыхательных путей.
При нарушении Т-звена иммунной системы больные подвергаются особой опасности поражения вирусными и грибковыми инфекциями. Часто первыми признаками иммунодефицита являются кандидоз, осложнения после вакцинации БЦЖ, тяжелые формы инфекций, обусловленных герпесом и возбудителем ветряной оспы. При клеточных формах иммунодефицита часто выявляется снижение количества и функциональной активности лимфоцитов периферической крови: в одних случаях снижается митогенная активация фито- гем-агглютинином, в других — уменьшается выработка лимфоцитов. Содержание В-лим- фоцитов может быть несколько увеличено, а Т-лимфоцитов — снижено. Однако часто количество Т-лимфоцитов и соотношение их популяций находится в пределах нормы, поэтому в диагностике клеточной иммунологической недостаточности приоритет должен отдаваться методам исследования, оценивающим функциональную полноценность лимфоцитов.
Среди первичных иммунодефицитов наиболее часто встречаются комбинированные формы. При тяжелом комбинированном иммунодефиците резко снижается активность естественных киллеров.
Вторичные иммунодефициты характеризуются приобретенным дефектом иммунной системы, выражающимся в неспособности организма осуществлять реакции клеточного и/или гуморального иммунитета. Дефекты иммунной системы при вторичных иммунодефицитах могут возникать в различных звеньях: Т- и В-лимфоцитарном, макрофагальном, гра- нулоцитарном, комплементном. Общий механизм возникновения вторичных иммунодефицитов заключается в нарушении естественно существующих идиотип-антиидиотип-взаимодействий между рецепторами клеток и циркулирующими иммуноглобулинами под влиянием различных стрессовых и патогенных агентов и воздействий.
В настоящее время еще не разработана классификация первичных и вторичных иммунодефицитов, удовлетворяющая требованиям клиницистов. Существующая международная классификация болезней {10-е издание, 1992 г.) выделяет следующие основные группы первичных иммунодефицитных состояний:
- иммунодефицит с преобладанием дефектов антител;
- комбинированные иммунодефицитные состояния;
- иммунодефицит в сочетании с другими значительными дефектами;
- дефекты в системе комплемента.
Многие заболевания, химиотерапевтические, физические и другие методы лечения, иные воздействия вызывают изменения иммунореактивности. Вторичные иммунодефициты наиболее часто выявляются при инфекциях, СПИДе, тяжелых ожогах, уремии, злокачественных новообразованиях, при проведении иммуносупрессивной и лучевой терапии Учитывая особенности патогенеза и локализации основного дефекта в иммунной системе, Д.К. Новиков и В.И. Новикова (1994) предложили приведенную ниже классификацию иммунодефицитов.
Классификация вторичных иммунодефицитов (основные группы):
- Комбинированные иммунодефициты;
- J-клеточные дефициты;
- ‘Преимущественно В-клеточные дефициты;
- Дефекты естественных киллеров;
- Дефициты макрофагов и гранулоцитов;
- Дефициты системы комплемента;
- Дефициты системы тромбоцитов.
Изменение основных показателей иммунного статуса при различных заболеваниях, вызывающих вторичные иммунодефициты, представлено в табл. 7.37.
Таблица 7.37. Характеристика вторичных иммунодефицитов
|
|
|
Индукторы |
|
|
|
Показатели |
бактериальные инфекции |
стресс |
неспецифические хронические заболевания |
лекарственные препараты, облучение |
|
Абсолютное количество лимфоцитов |
4, реже 4 |
4 |
4 или 4 |
4 |
|
Количество CD3 |
4 |
4 |
4 |
4 |
|
Количество CD4 |
Т или 4 |
4 |
t или 4 |
4 |
|
Количество CD8 |
Т |
4 |
t |
4 |
|
Количество CD20 |
t |
t или 4 |
Н или 4 |
Н или 4 |
|
И мму ноглобул ины |
Дисиммуно- |
Дисиммуно- |
Дисиммуно- |
Дисиммуно- |
|
|
глобулинемия |
глобулинемия |
глобулинемия |
глобулинемия |
|
Фагоцитоз |
Т или 4 |
Т |
4 или 4 |
4 |
Изменения иммунореактивности, временно возникающие при различных воздействиях и заболеваниях и спонтанно исчезающие при устранении индуцирующих факторов, не являются иммунодефицитами. Их следует считать временной иммуномодуляцией. Однако граница между вторичными иммунодефицитами и временным нарушением иммунореактивности относительна и условна.
Опыт применения иммунологических методов в клинической практике позволяет сформулировать некоторые правила оценки иммунограмм клиницистом [Лебедев К.А., Поняки- на И.Д., 1990]. ' ;
- Комплексный анализ иммунограммы более информативен, чем оценка каждого показателя в отдельности.
- Полноценный анализ иммунограммы можно проводить лишь в комплексе с оценкой клинической картины у данного больного.
- Реальную информацию в иммунограмме несут сильные сдвиги показателей; слабые сдвиги лишь позволяют повысить уверенность в правильности сделанного заключения.
- Анализ иммунограммы в динамике как в диагностическом, так и в прогностическом отношении всегда более информативен, чем однократно полученная иммунограмма.
- В подавляющем большинстве случаев анализ иммунограммы дает возможность делать ориентировочные, а не безусловные выводы диагностического и прогностического характера.
- Первостепенную практическую значимость в иммунограмме имеют соотношения различных популяций и субпопуляций им му некомпетентных клеток, а не их абсолютные значения.
- Несоответствие сдвигов показателей иммунограммы клинической картине течения заболевания свидетельствует о тяжелом, неблагоприятном развитии процесса.
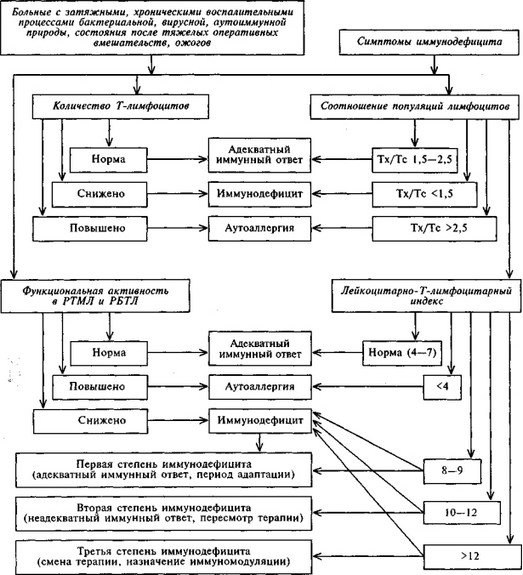
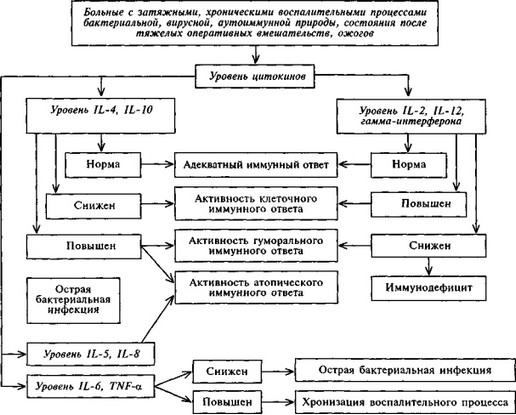
Для облегчения комплексной оценки иммунного статуса приводим алгоритмы оценки каждого звена иммунитета (схемы 7.1 — 7.5). При оценке клеточного звена иммунитета, помимо отношения Т-хелперы/Т-супрессоры (Тх/Тс), важное значение имеет отношение общего количества лейкоцитов в крови к общему количеству Т-лимфоцитов — лейкоцитарно- Т-лимфоцитарный индекс, который в норме составляет 4—7.
Несмотря на широко распространенное в настоящее время утверждение о том, что состояние иммунной системы может быть во многих случаях решающим фактором при развитии многообразной патологии у человека, до сих пор вопрос об оценке иммунного статуса остается дискутабельным. Подходы к оценке иммунного статуса можно разделить на 2 большие категории:
- подходы с использованием универсального (одиночного) способа оценки;
- подходы, связанные с рекомендацией различных наборов методов и тестов, наиболее полно отражающих состояние иммунной системы.
И те, и другие имеют свои плюсы и минусы. С одной стороны, первый тип подходов с определением универсального показателя состояния иммунной системы имеет несомненное преимущество, так как при этом отпадает необходимость конструирования сложных и порой громоздких схем для интерпретации получаемых результатов. Вместе с тем на основании интегрального универсального показателя можно выявить только грубые изменения в иммунной системе, тогда как пограничные состояния остаются за пределами его детекции. Второй тип подходов с определением многочисленных параметров иммунного статуса, наоборот, дает более полное представление о состоянии иммунной системы и выявляет тонкие механизмы ее поражения, однако общая интерпретация получаемых данных бывает весьма затруднительной, а порой и совсем неопределенной.
Предложенный в 1990 г. Л.В. Ковальчуком и А.Н. Чередеевым подход к оценке иммунной системы человека, базирующийся на патогенетическом принципе, получает свое дальнейшее развитие. Сущность этого подхода заключается в использовании методических приемов, позволяющих оценить основные стадии иммунного ответа — распознавания, активации, пролиферации и дифференцировки. Помимо традиционных тестов (первого уровня), в основу патогенетического принципа положены рекомендации оценивать наиболее важные свойства жизнеобеспечения иммунокомпетентных клеток, ориентируясь на основные этапы их дифференцировки. Для упорядочения основных процесов предложено оценивать способность клеток иммунной системы к активации, пролиферации, дифференциации и регуляции. Дальнейшие разработки в этой области подтвердили правильность указанных подходов к лабораторной диагностике состояния иммунной системы человека.
- Оценка стадии распознавания антигена: изучение уровня Т-клеточного антиген-рас- познающего рецептора на лимфоцитах, процесса представления антигена, числа адгезивных молекул (интегрины, адгезины и др.) на клетках, смешанной культуры лимфоцитов, генного анализа аллотипов HLA, ТКР.
- Оценка стадии активации лимфоцитов: фенотипирование маркеров активации лимфоцитов (CD25, CD23, CD 69, HLA-DR) при стимуляции ФГА, выявление вторичных мес- сенжеров (цАМФ, цГМФ, цАТФ), изучение отвечаемости клеток иммунной системы на цитокины.
- Оценка стадии пролиферации лимфоцитов: изучение ответа лимфоцитов на митогены, специфические антигены, факторы роста.
- Оценка стадии дифференциации лимфоцитов (эффекторноЙ функции): изучение продукции иммуноглобулинов, цитотоксической функции Т-лимфоцитов, натуральных киллеров, продукции цитокинов.
5. Оценка регуляции иммунного ответа: оценка хелперных и супрессорных функций лимфоидных клеток, анализ функциональных свойств Т-хелперов 1-го и 2-го типов и продуцируемых ими цитокинов.
Главное достоинство патогенетического принципа обследования иммунной системы заключается в упорядочивании тестов, оценивающих состояние важных и взаимосвязанных функций иммунокомпетентных клеток. Выделение подобных этапов функционирования иммунных клеток открывает перед врачом новые подходы для понимания роли отдельных клеточных элементов иммунной системы человека при многих иммунных нарушениях.
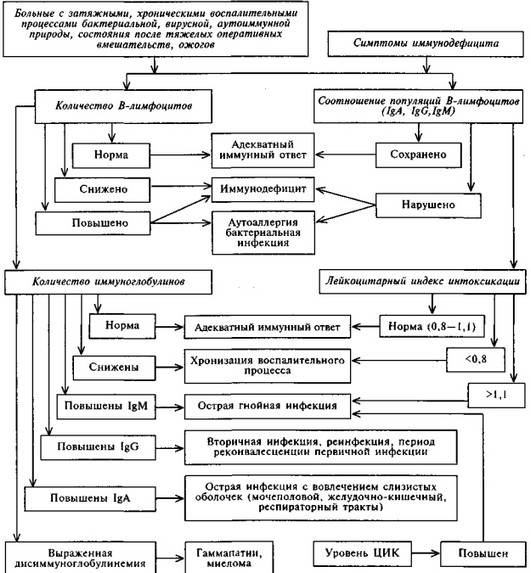
Схема 7.2. АЛГОРИТМ ОЦЕНКИ ГУМОРАЛЬНОГО ЗВЕНА ИММУНИТЕТА
ПРИ ИММУНОДЕФИЦИТАХ
В настоящее время в литературе накоплен огромный фактический материал по механизмам активации, пролиферации и дифференцировке лимфоцитов [Чередеев А.Н., 1997], Известны тонкие мембранные и внутриклеточные перестройки при этих процессах. Становится ясным, что врожденный или индуцированный разными факторами блок одного из названных ключевых этапов функционирования нммунокомпетентных клеток ведет к несостоятельности их полноценного функционирования. Данные последних лет свидетельствуют о качественно новой интерпретации тестов, применяемых для оценки иммунной системы, связанных с определением состояния активации лимфоцитов. Сегодня исследователи практически единодушны в том, что процесс активации иммунокомпетентных клеток в зависимости от ряда внешних и внутренних факторов может иметь по крайней мере два исключающих друг друга исхода, в связи с чем выдвигается концепция позитивных и негативных последствий активации.
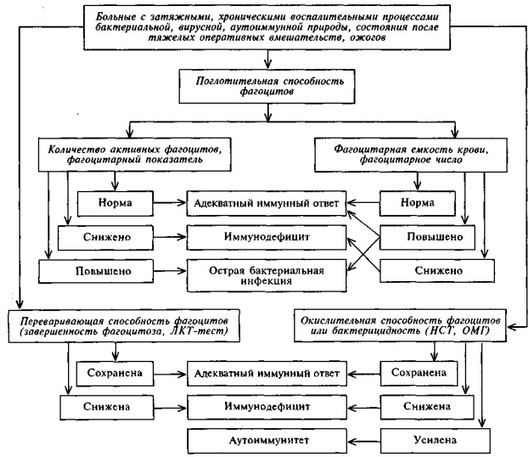
Схема 7.3. АЛГОРИТМ ОЦЕНКИ СИСТЕМЫ ФАГОЦИТОЗА
ПРИ ИММУНОДЕФИЦИТАХ
После активации иммунокомпетентные клетки проходят типичный путь своего развития, те. начинают пролиферировать и после этого дифференцируются в зрелые клетки, обеспечивающие эффекторные функции иммунной системы (позитивный процесс). Или тот же самый стимул, направленный на ту же популяцию клеток, но осуществленный в других условиях, может привести к совершенно противоположному эффекту — к запрограммированной гибели активируемой клетки, т.е. к феномену апоптоза (негативный процесс). Эти процессы наиболее существенны для Т-лимфоцитов. Именно поэтому на сегодняшний день при оценке состояния активации лимфоцитов правомерным является определение типа активации, с которым имеет дело исследователь: позитивным или негативным. Данные факты и составляют суть методологического подхода при оценке процессов, связанных с активацией иммунокомпетентной клетки.
Позитивная активация лимфоцитов — сложный и многогранный процесс, реализуемый через биохимические события в мембране и в цитозоле клетки. На конечном этапе активации Т-лимфоцитов реализуются эффекторные функции: секреция цитокинов, цитотоксичность и др. Но прежде клетки проходят этап пролиферации, необходимый для накопления пула себе подобных клеток. Фазы активации, пролиферации и дифференцировки имеют свои особенности и могут быть оценены по следующим параметрам: повышение экспрессии CD25 антигенов и антигенов HLA-DR в ранней стадии активации, стимуляция роста активированных В-клеток в стации пролиферации, индукция синтеза иммуноглобулинов (в частности, IgE) в стадии дифференцировки.
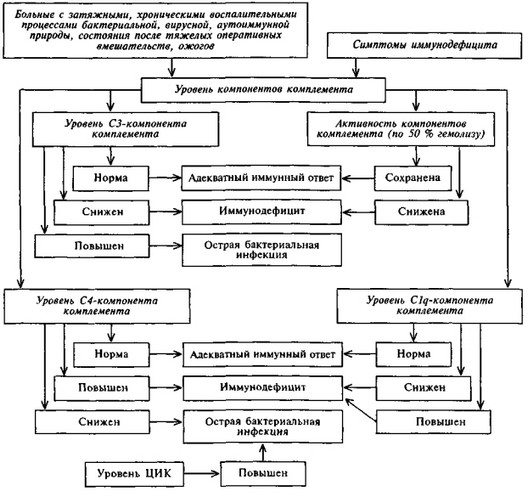
Схема 7.4. АЛГОРИТМ ОЦЕНКИ СИСТЕМЫ КОМПЛЕМЕНТА
ПРИ ИММУНОДЕФИЦИТАХ
В противовес классическим путям позитивной активации зрелые Т-клетки, стимулированные через Т-клеточные рецепторы, могут подвергнуться и клеточной гибели (негативная активация), при которой решающую роль играет взаимодействие пары рецептор- лиганд Fas/FasL. Активированные Т-лимфоциты экспрессируют как тот, так и другой рецептор и становятся чувствительными к клеточной гибели, являющейся следствием связывания Fas-рецептора. Такие клетки могут поставлять сигналы бедствия от одной клетки другой — процесс, получивший название «братоубийство». Поэтому наряду с методами, характеризующими процессы позитивной активации, назрела необходимость определения маркеров, по которым можно количественно охарактеризовать число клеток «самоубийц», подвергающихся апоптозу. Одними из таких маркеров являются антиген Fas (CD95, АПО-
- и лиганд FasL. Fas относится к рецепторам фактора некроза опухолей. Он проводит апоптотический сигнал внутрь клетки. События апоптоза реализуются после соединения Fas-антигена с FasL-лиганд ом (антителом). У клеток, подвергающихся апоптозу, происходят изменения в характере гликозилирования белков поверхностных мембран. Одним из маркеров таких изменений считается появление Lewis Y-антигена, который обнаруживается иммуногистохимическими методами. Как в нормальных, так и в опухолевых клетках показана хорошая корреляция между степенью апоптоза и величиной экспрессии антигена Lewis Y.
Идентификация этих маркеров играет важную роль для заключения о направленности развития клеток иммунной системы, механизмах и течении иммунопатологии человека. Например, многие приобретенные иммунодефициты могут быть связаны с эффектом негативной активации. Повышенный апоптоз Т-лимфоцитов рассматривается как один из ключевых механизмов иммунодефицита при ВИЧ-инфекции. Существует также концепция интер- лейкинзависимых иммунодефицитов, согласно которой в основе этих дефицитов лежат нарушения механизмов регуляции клеточной активации и пролиферации в зависимости от продукции и рецепции цитокинов IL-1, IL-2. Экспериментальное обоснование получает и предположение о том, что в основе многих лимфопролиферативных и аутоиммунных заболеваний лежит процесс нарушения клеточного апоптоза по типу блока негативных процессов активации, в результате чего возникает неудержимая клеточная пролиферация, в том числе и «запрещенных» клонов лимфоцитов.
Таким образом, патогенетический подход к оценке иммунного статуса позволяет по-новому осмыслить природу возникновения иммунопатологии. Распространенное утверждение о том, что иммунодефициты — это заболевания, связанные с недостаточностью функционирования иммунной системы, а аутоиммунные заболевания — патология с гиперфункцией иммунной системы, на сегодняшний день может оказаться лишь поверхностным. На самом деле, и иммунодефицитные, и аутоиммунные заболевания являются по своей сути процессами чрезмерной активации иммунокомпетентных клеток, однако при иммунодефицитах их активация заканчивается гибелью, а при аутоиммунных дефицитах — активация приводит к накоплению аутореактивных клонов. Поэтому оценка иммунного статуса должна включать максимальный перечень тестов и показателей, характеризующих основные этапы активации, пролиферации и дифференцировки лимфоцитов, системы комплемента и фагоцитоза.
