Фибрилляция и трепетание предсердий
Фибрилляция предсердий является наджелудочковой формой тахиаритмии, которая характеризуется наличием некоординированности возбуждения предсердий, что вызывает нарушение их механической функции.
Распространенность фибрилляции предсердий в общей популяции составляет около 0,5%. В первом длительном эпидемиологическом исследовании в г. Фремингеме (США) было выявлено наличие прямой зависимости распространенности и частоты возникновения ФП от возраста. В течение 22 лет наблюдения за мужской популяцией данная форма аритмии возник-
Таблица 2
Распространенность фибрилляции предсердий (ФП) в общей популяции
|
Исследование |
К-во обследованных |
Возраст |
Распространен- ностьФП (%) |
|
Tecumseh |
5129 чел. (муж. - 52%, |
gt;16 лет |
0,4 |
|
|
жен. - 48%) |
муж. |
0,52 |
|
|
|
жен. |
0,33 |
|
|
|
gt;60 лет |
3,3 |
|
Reykjavik |
9067 (муж. - 48%, |
32-64 гг. |
0,26 |
|
|
жен. - 52%) |
|
|
|
Edinburgh |
Выборка из 27 тыс. чел. |
62-90 лет |
5,0 |
|
Australia |
1770 чел. |
60-64 гг. |
1,7 |
|
|
|
65-69 лет |
3,0 |
|
|
|
70-74 гг. |
7,0 |
|
|
|
gt;75 лет |
11,6 |
ла у 0,22% среди тех, кто при первом обследовании имел возраст 25-34 года, и у 3,7% - в возрастной группе 55-64 года. Эти данные были подтверждены в других эпидемиологических исследованиях (табл. 2). Распространенность аритмии особенно быстро увеличивается в возрастных группах 65 лет и старше, достигая 11,6% у лиц старше 75 лет. Ежегодно новые случаи фибрилляции предсердий регистрируются у 0,5% лиц в возрасте после 60 лет. Увеличение распространенности ФП в старших возрастных группах ассоциируется с увеличением числа больных, имеющих заболевания сердца. Но при этом нельзя исключить также возможность появления изменений в миокарде предсердий, связанных с возрастом.
Поданным Фремингемского исследования более чем половина больных сданной аритмией страдали артериальной гипертонией. Вторым очень важным предиктором возникновения ФП является сердечная недостаточность. Сахарный диабет также увеличивает риск её появления в 3 раза. Ишемическая болезнь сердца, при исключении из анализа больных с артериальной гипертонией и сердечной недостаточностью, не оказывает статистически значимого влияния на частоту возникновения фибрилляции предсердий. Но достоверная связь выявляется между приступами ишемии миокарда и пароксизмами ФП, а также с наличием дисфункции левого желудочка.
У мужчин мерцательная аритмия встречается в 1,5 раза чаще, чем у женщин. Предикторами её по данным эхокардиографии являются увеличенные размеры левого предсердия, утолщенные стенки левого желудочка и сниженная сократимость миокарда. Частота возникновения аритмии нараста
ет параллельно увеличению степени выраженности перечисленных предикторов с 3,7 до 17% в год.
При обследовании больных с ФП в среднем у 20% не выявляются структурные изменения сердца, т.е. с помощью имеющихся в клинике в настоящее время методов исследования сердечно-сосудистой системы не удается диагностировать какого-либо заболевания. Поэтому в таких случаях говорят об идиопатической форме ФП.
Прогноз жизни. До недавнего времени было широко распространено мнение, что наличие ФП у больных с неревматическими заболеваниями сердца не ассоциируется с ухудшением прогноза жизни. Поэтому основной рекомендацией по лечению было урежение ритма желудочков. Но уже первые данные, полученные во Фремингемском исследовании, показали, что у больных с неревматическими заболеваниями сердца и ФП по сравнению с теми, кто её не имел, общая летальность была в 2 раза выше. Средняя продолжительность жизни больных с аритмией после её возникновения составила 6 лет. У больных с ревматическими пороками сердца и ФП риск возникновения инсульта был в 17,6 раза выше, чем у больных с неревматическими заболеваниями сердца. У больных ИБС с мерцательной аритмией риск летального исхода также выше (в 2,7 раза) по сравнению с группой больных без аритмии. Наличие ФП увеличивает не только общую летальность, но ещё более значимо - летальность от сердечно-сосудистых заболеваний (в 6-7 раз) и цереброваскулярных осложнений (в 4-12 раз). Увеличенный риск летального исхода наиболее высок при постоянной форме ФП, хотя и при пароксизмальной форме летальность увеличивается в 1,5-2 раза (табл. 3).
Эмболии в большой круг кровообращения у больных ФП регистрируются примерно у 5-6% больных ежегодно. Большинство из них (около 70%) составляют больные с тромбоэмболией в сосуды мозга. В течение многих лет предполагалось, что риск тромбоэмболии у больных с трепетанием предсердий небольшой и поэтому не рекомендовали проведение антикоагулян- тной терапии. Однако в 2001 г. были опубликованы результаты 8-летнего наблюдения за большим количеством таких больных (17413 больных), которые показали, что риск возникновения инсульта среди них также существенно увеличен. Поэтому при оценке риска тромбоэмболии и эффективности профилактики ишемический инсульт выступает как основной показатель. В целом, среди всех больных с инсультами тромбоэмболия, как их причина, выявляется у 15% и основным источником её является тромбоз левого предсердия. У большого числа больных (44-63%) ишемический инсульт приводит к летальному исходу или к инвалидизации больного. Из приве-
Таблица 3
Показатели летальности в зависимости от наличия ФП
|
Исследование |
Длительность наблюдения (гг.) |
Возраст (г.) |
Летальность (%) |
|
|
У б-х с МА |
У б-х без ФП |
|||
|
Reykjavik |
14 |
32-64 |
Общая - 32 |
20 |
|
Сосудистая - 20 |
6 |
|||
|
Цереброваск. - 20 |
2 |
|||
|
Edinburgh |
5 |
62-90 |
Общая - 67 |
27,3 |
|
Australia |
2-17 |
gt;60 |
Всего умерло 42,5, при наличии МА - в 1,9 раза больше, в т.ч. инсульт - в 3,8 раза чаще |
|
|
Bermingam |
24 |
30-62 |
Мужчины: риск увеличен:
Женщины: риск увеличен:
|
|
|
Многоцентр. исследования по коронарной хирургии у больных ИБС (CASS study) |
7 |
Из 18343 чел. 67% в возрасте 40-59 |
Общая летальность была в 2 раза выше у больных с МА |
|
денных в табл. 4 данных следует, что ежегодно у 4-6% больных ФП регистрируется возникновение ишемического инсульта.
Наличие у больных пароксизмальной формы аритмии, по сравнению с её постоянной формой, сочетается с меньшим риском тромбообразования, хотя и не исключает его. По некоторым данным риск ишемического инсульта составляет 1,3-2% ежегодно, т.е. в 3-7 раза меньше, чем при постоянной форме аритмии. Примерно у трети больных с инсультом (37%) давность наличия аритмии не превышала 2 лет, а у каждого четвертого больного ФП впервые была установлена в связи с возникновением инсульта.
У больных, переживших ишемический инсульт, сохраняется повышенный риск его рецидива. По некоторым данным, полученным в небольших исследованиях, частота рецидивов достигала 13-33% в сроки от 10 дней до 2,5 мес. соответственно.
В последних работах, включавших небольшое количество больных (140 чел.), этот показатель был ниже. Но в целом у больных с рецидивом
Таблица 4
Частота возникновения инсультов у больных с ФП
|
Исследование |
Количество б-х с ФП |
Длительность наблюдения |
Частота инсультов (в % год) |
|
Framingham |
303 |
30 лет |
3,8 |
|
Montreal |
254 |
3,3 г. |
5,5 |
|
AFASAK (Копенгагенское исследование,контрольная группа больных) |
336 |
2,2 г. |
4,9 |
|
SPAF (контрольная группа из исследования по профилактике инсульта) |
528 |
1,13г. |
5,7 |
эмболии на протяжении ближайших 2-х лет примерно у 50% из них его возникновение наблюдалось в течение первых 2-х недель.
В соответствии с рекомендациями, разработанными совместно экспертами Американского общества кардиологов, Европейского общества кардиологов и Северо-Американского общества электрофизиологов, фибрилляция предсердий разделяется на следующие формы: 1) пароксизмальная форма (самостоятельно купирующаяся); 2) персистирующая (самостоятельно не купирующаяся); 3) перманентная (постоянная) форма.
Пароксизмальная форма может быть впервые возникшей и рецидивирующей (2 и более приступа). При этом приступ может длиться от 30 сек. до 7 дней (в большинстве случаев в пределах до 24 час.). Персистирующая форма также может быть впервые возникшей или рецидивирующей и обычно длится более 7 дней и купируется с помощью лекарственных препаратов или электрошока. Случаи, когда персистирующая форма длится более 1 года и восстановление синусового ритма не производилось, либо имелись противопоказания для восстановления, классифицируют как постоянную форму фибрилляции предсердий.
У некоторых больных фибрилляция предсердий возникает впервые в связи с острым заболеванием или хирургическим вмешательством (острый инфаркт миокарда, острый перикардит или миокардит, эмболия легочной артерии, острая пневмония или другие острые заболевания легких, хирургическая операция на сердце). Эта форма аритмии классифицируется как вторичная. В большинстве таких случаев после успешного лечения основного заболевания и купирования данного осложнения, фибрилляция предсердий не возобновляется.
У большинства больных с фибрилляцией, трепетанием предсердий выявляются заболевания сердца: 1) клапанные пороки (наиболее часто встречается стеноз митрального клапана); 2) неклапанные поражения сердца
(артериальная гипертония, кардиомиопатии, сахарный диабет, ишемическая болезнь сердца, констриктивный перикардит и т. д.). И только у небольшого числа больных не удается с помощью клинического и неинвазивного инструментального обследования выявить какие-либо патологические изменения со стороны сердечно-сосудистой системы. Такую форму аритмии считают идиопатической.
Механизм возникновения аритмии. Гистологические исследования у больных с фибрилляцией предсердий выявляют наличие в них участков фиброза, жировой инфильтрации, что может быть последствием воспаления или дегенерации тканей. У больных амилоидозом, саркоидозом или гемохро- матозом и поражением сердца обнаруживают инфильтраты в миокарде предсердий. Иногда единственным изменением является гипертрофия миофибрилл предсердий, которая очень часто выявляется у больных с персистирующей формой фибрилляции предсердий. При наличии застойной сердечной недостаточности возникновению персистирующей формы аритмии способствует интенсивно развивающийся интерстициальный фиброз. У больных, имеющих семейную (возможно генетическую) предрасположенность к возникновению аритмии, и у которых выявляется высокий уровень в крови антител к миозину тяжелых цепей, предполагается, что важную роль в возникновении аритмии играют аутоиммунные механизмы. У членов такой семьи при регистрации усиленной ЭКГ очень рано выявляются изменения зубца Р (рис. 16).
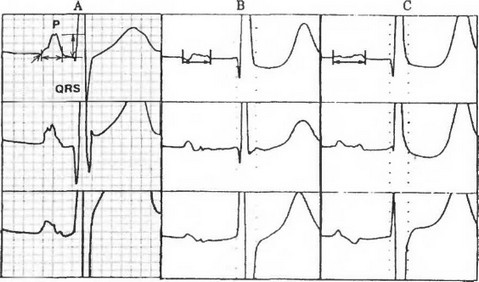
Рис. 16. ЭКГ высокого разрешения: А - нормальная ЭКГ здорового человека; В, С, - ЭКГ больных, у которых возникла мерцательная аритмия в отдаленные сроки наблюдения. На исходной ЭКГ зарегистрировано значительное уменьшение вольтажа зубца Р, а также увеличение его продолжительности
Существует две гипотезы относительно возможного электрофизиологи- ческого механизма возникновения фибрилляции предсердий: 1) усиленный автоматизм в одном или нескольких быстро деполяризующихся участках; 2) ри-энтри с одним или несколькими кругами циркуляции возбуждения.
Однако независимо от механизма возникновения фибрилляции предсердий пусковым ее фактором в большинстве случаев выступают экстрасистолы.
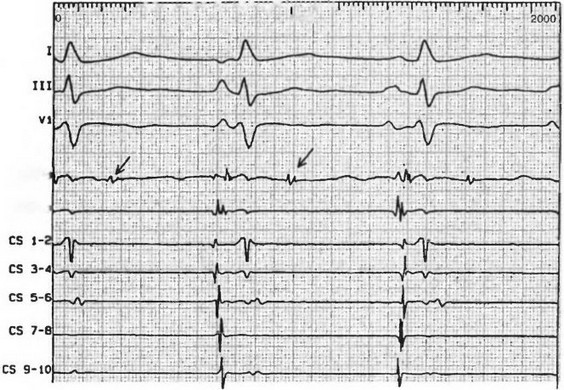
Эктопический очаг (или очаги) возбуждения, приводящий к возникновению ФП, выявляют в устье одной или нескольких легочных вен, в правом предсердии, а иногда и в верхней полой вене или коронарном синусе. Очаги усиленной эктопической активности чаще выявляют у больных с пароксизмальной формой аритмии (рис. 17).
 Одновременная регистрация потенциалов с помощью большого количества электродов демонстрирует наличие нескольких волн циркуляции возбуждения предсердий, возникающих, по-видимому, в результате фрагментации основной
Одновременная регистрация потенциалов с помощью большого количества электродов демонстрирует наличие нескольких волн циркуляции возбуждения предсердий, возникающих, по-видимому, в результате фрагментации основной
I Ц м I I {»I l|j М I Ц 111 Ц М 11 [ГП Г1» 1 gt; | I'll |'|
¦ 1000
UJPVd
LUPVp
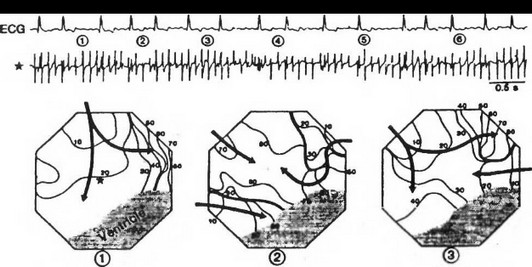

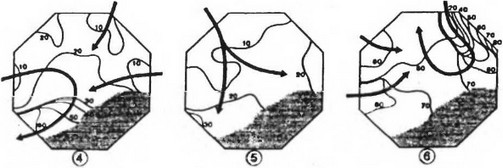 Рис. 17. На внутрисердечной электрограмме выявлено наличие блокированного эктопического импульса, исходящего из левой верхней легочной вены (ЛВЛВ): Vj - грудное ЭКГ отведение; LUPVd - отведение от дистального участка ЛВЛВ; LUPVp - отведение от проксимального участка ЛВЛВ; CS 1-10 - отведения от различных участков коронарного синуса. Стрелка - обозначение блокированного эктопического импульса [Адаптировано с «Еигорасе», 2002,4,3]
Рис. 17. На внутрисердечной электрограмме выявлено наличие блокированного эктопического импульса, исходящего из левой верхней легочной вены (ЛВЛВ): Vj - грудное ЭКГ отведение; LUPVd - отведение от дистального участка ЛВЛВ; LUPVp - отведение от проксимального участка ЛВЛВ; CS 1-10 - отведения от различных участков коронарного синуса. Стрелка - обозначение блокированного эктопического импульса [Адаптировано с «Еигорасе», 2002,4,3]волны ри-энтри, что приводит к появлению «дочерних волн». Количество их зависит от величины рефрактерных периодов, массы миокарда и проводимости в различных участках предсердий (рис. 18). Пути ри-энтри формируются случайно и поэтому наблюдается их непостоянство. Но чаще всего возбуждение циркулирует вокруг устья легочных вен, нижней или верхней полых вен, распространяясь на правое и левое предсердия и их ушки (рис. 19 А).
Рис. 19 А. Электроанатоми- ческая карта левого предсердия (адаптировано с Eur. Heart J., 23, 2002).
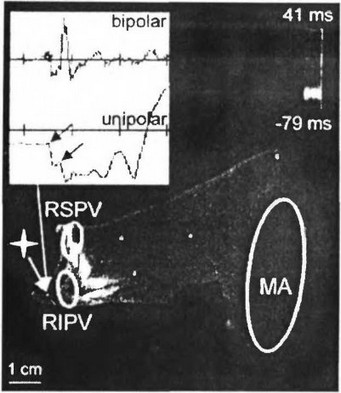 Обозначения: RSPV - правая верхняя легочная вена; RIPV - правая нижняя легочная вена; МА - митральное отверстие. Звездочка со стрелкой - место наиболее раннего появления импульса возбуждения; 41 ms и 79 ms - время появления активности при картировании. В светлом квадрате - электрограмма, зарегистрированная с помощью биполярного и однополярного электродов. На однополярной электрограмме стрелками обозначено отрицательная направленность импульса в месте, где локализуется эктопический очаг (в правой нижней легочной вене)
Обозначения: RSPV - правая верхняя легочная вена; RIPV - правая нижняя легочная вена; МА - митральное отверстие. Звездочка со стрелкой - место наиболее раннего появления импульса возбуждения; 41 ms и 79 ms - время появления активности при картировании. В светлом квадрате - электрограмма, зарегистрированная с помощью биполярного и однополярного электродов. На однополярной электрограмме стрелками обозначено отрицательная направленность импульса в месте, где локализуется эктопический очаг (в правой нижней легочной вене)
В последние годы сформировалось представление о наличии феномена элек- трофизиологического ремоделирования предсердий. Наличие феномена электрического ремоделирования предсердии впервые было показано в эксперименте на козах. Электростимуляция с большой частотой предсердий в начале эксперимента вызывала короткий пароксизм фибрилляции предсердий. Повторные провокации аритмии сопровождались прогрессивным увеличением продолжительности пароксизмов и спустя 1-2 недели, вызываемая электрокардиостимуляцией пароксизмальная форма аритмии переходила в хроническую. Внутриклеточные исследования показали, что при непродолжительном навязывании частого ритма сердца увеличивается выход ионов из клетки, в частности,увеличивается натрий-кальциевый обмен, возникает перегрузка клеток кальцием, укорачивается эффективный рефрактерный период. Использование на этом этапе для лечения антагонистов кальция может уменьшать перегрузку клетки ионами кальция и тормозить нарастание укорочения рефрактерного периода. Но пока остается не ясным, какие анатомические изменения могли возникнуть в предсердиях за это время и какая их роль в превращении аритмии в постоянную форму. У больного человека такими факторами являются дилятация полостей сердца, увеличение напряжения на стенки предсердий, фиброз их миокарда, а также дезорганизация расположения миофибрилл.
Электрофизиологическое ремоделирование сопровождается уменьшением продолжительности эффективного рефрактерного периода предсердий и возникает в течение 24 часов от начала их фибрилляции. Возникновение ремоделирования тормозится при быстром купировании приступа, а также с помощью блокады кальциевых каналов. Изменения транспорта ионов связывают с модификацией молекул белка в каналах сарколемы кардиомиоци- тов. Механизмом данной модификации считают возникновение нарушений в экспрессии генов.
Длительно сохраняющаяся фибрилляция предсердий вызывает резкое угнетение сократимости миокарда предсердий, которое может продолжаться от нескольких дней до нескольких недель, несмотря на восстановление синусового ритма. Эти данные обосновали необходимость проведения антикоа- гулянтной терапии в течение длительного времени после нормализации ритма сердца. Замедленное восстановление сократимости миокарда предсердий объясняют возникновением состояния «оглушенности» или «гибернации».
Активность автономной нервной системы играет важную роль в возникновении и в сохранении фибрилляции предсердий. Пароксизмы фибрилляции у части больных возникают только во время сна или после приема пищи, что объясняется в таких случаях увеличением тонуса парасимпатической нервной системы. Это чаще наблюдается у больных, не имеющих явных органических заболеваний сердца. И, наоборот, у больных с патологией сердца аритмия чаще провоцируется при активации симпатического тонуса (физический или эмоциональный стресс, инфузия изопротеренола). Такая четкая зависимость обычно выражена в ранние сроки заболевания. В последующем преобладание влияния симпатической или парасимпатической нервной системы можно определить с помощью оценки вариабельности сердечного ритма при суточном мониторировании ЭКГ.
Используя технику видеоизображения с высокой разрешающей способностью, в эксперименте на овцах было показано, что волны фибрилляции имеют организованный характер. Фронт возбуждения возникает с определенной последовательностью, периодичностью и приобретает определенную форму в результате формирования ри-энтри в одном или нескольких участках предсердия. Длина пути, по которому распространяется волна (фронт) возбуждения, в значительной степени зависит от величины предсердия, влияющей на скорость проведения и рефрактерность. Такая возможность подтверждена у больных с синдромом WPW и фибрилляцией предсердий, подвергшихся хирургическому лечению. У этих больных было выявлено несколько типов возникновения фибрилляции предсердий. Например, при первом типе была зарегистрирована одна волна возбуждения, рас
пространившаяся по правому предсердию и вызвавшая фибрилляцию. Для второго типа было характерно возникновение одного или двух фронтов возбуждения, распространявшихся в различных направлениях.
Во время фибрилляции предсердий количество импульсов возбуждения, проводимых на желудочки подвержено значительным колебаниям, что связано с задержкой части из них в атриовентрикулярном (АВ) узле. Возбуждение от предсердия к узлу распространяется по задней его поверхности вдоль crista terminalis, а по передней - вдоль межпредсердной перегородки. Задержка в АВ узле части импульсов, в основном, зависит от наличия скрытого их проведения, т.е. часть импульсов доходит до узла и не проводится на желудочки.
Но задержка импульсов определяется также собственной рефрактерно- стью АВ узла и влиянием симпатической и парасимпатической нервной системы. Колебания тонуса этих двух отделов автономной нервной системы влияют как на рефрактерность, так и на скрытую проводимость тканей узла. Наличие такой зависимости демонстрируется изменениями частоты желудочкового ритма в состоянии покоя или сна, во время активной деятельности человека, а также в результате приема гликозидов преимущественно влияющих на тонус вагуса, или бета-адреноблокаторов, которые уменьшают влияние адренергической системы.
У больных, которые имеют дополнительные пути проведения возбуждения от предсердий на желудочки, имеются предпосылки для его проведения по ним в антероградном или ретроградном направлении во время пароксизма тахикардии.
При антероградном проведении импульса на желудочки по пучку Кента его распространение происходит без существенной задержки. Это связано с тем, что феномен скрытого проведения в дополнительном пути не играет существенной роли. Поэтому фибрилляция предсердий нередко провоцирует возникновение фатальной фибрилляции желудочков. Усиление симпатического тонуса ускоряет проведение импульсов по дополнительному пути. Такое же действие оказывают некоторые препараты, тормозящие проведение возбуждения только в АВ узле (сердечные гликозиды, пульсурежа- ющие антагонисты кальция, бета-блокаторы).
Нарушения гемодинамики. Возникновение фибрилляции предсердий приводит к исчезновению систолы предсердий, появлению нерегулярного ритма желудочков и не одинакового их наполнения в диастолу, что особенно усугубляется при большой частоте ритма. В результате значительно снижается сердечный выброс, особенно у больных, имеющих нарушение диастолической функции сердца (артериальная гипертония, гипертрофическая
кардиомиопатия, рестриктивные заболевания сердца). Нарушение ритма желудочков сопровождается также появлением митральной регургитации.
Структурные изменения сердца. Сохраняющийся частый ритм предсердий или фибрилляция предсердий приводит к дилятации предсердий, к увеличению размеров митохондрий, возникновению разрывов саркоплазма- тического ретикулума. Наличием этих изменений объясняется замедленное (до нескольких недель) восстановление систолы предсердий после нормализации ритма сердца.
Высокая частота ритма желудочков (более 130 в 1 мин), сохраняющаяся в течение длительного времени, вызывает также дилятацию желудочков (та- хизависимая кардиомиопатия), механизм возникновения которой пока не выяснен. Восстановление нормального ритма сердца в таких случаях приводит к значительному уменьшению или даже нормализации размеров полостей желудочков и восстановлению сократимости миокарда.
Тромбоз левого предсердия. При фибрилляции предсердий тромб формируется в ушке левого предсердия. Транспищеводная допплерэхокарди- ография выявляету таких больных наличие значительного уменьшения скорости кровотока в полости предсердия и особенно в его ушке. Значение стаза крови в формировании тромба подтверждается также тем, что у больных с трепетанием предсердий скорость кровотока нарушена в меньшей степени и у них реже встречается тромбоз ушка и реже возникает тромбоэмболия.
У части больных выявляют повышенный уровень тромбоглобулина, тром- боцитарного фактора - 4, фактора Виллебранда. Но остается неясным, регистрируемые нарушения (биохимические маркеры) имеют характер первичных или вторичных изменений по отношению к тромбозу предсердия.
Проводившиеся исследования у больных с митральным стенозом во время баллонной вальвулопластики показали, что именно в левом предсердии имеются нарушения свертывания крови (увеличено содержание фибрино- пептида А, комплекса тромбин/антитромбин III, протромбиновых фрагментов Fl,2) по сравнению с данными, полученными при исследовании крови, взятой из правого предсердия и периферической вены. Эти данные позволяют предполагать, что в образовании тромба в левом предсердии более важную роль играют местные факторы, а не системные нарушения.
Транспищеводная допплерэхокардиография обнаруживает эхоконтрастные образования в левом предсердии спустя 48 ч (иногда и раньше) с момента возникновения фибрилляции предсердий. Риск образования тромба в левом предсердии при данном заболевании резко увеличивается параллельно увеличению возраста, особенно после 65 лет, у больных артериаль
ной гипертонией и сердечной недостаточностью, а также при наличии выраженного атеросклеротического поражения аорты, в частности ее дуги.
Содержание в крови биохимических маркеров свертывания крови, активация тромбоцитов увеличиваются с возрастом, включая больных с фибрилляцией предсердий, и пока не установлены критерии, позволяющие выделять группу повышенного риска тромбоза предсердий.
Клинические данные. У большинства больных с фибрилляцией предсердий выявляется органическая патология сердца: клапанные пороки (особенно стеноз митрального клапана), ишемическая болезнь, артериальная гипертония, кардиомиопатия, врожденные заболевания, воспалительные поражения (миокардит, констриктивный перикардит). Фибрилляция предсердий очень часто возникает у больных с апноэ во время сна. Фибрилляция предсердий является характерным симптомом для больных с гипертирео- зом, в т.ч. вызванным неадекватной дозировкой гормонов щитовидной железы при лечении ее заболеваний, особенно когда лечение основывается только на результатах биохимического анализа без учета клинических данных.
У многих молодых больных с фибрилляцией предсердий (около 20%) с помощью доступных методов не находят явных изменений со стороны сердца и других органов, которые могут быть причиной аритмии. У части из них фибрилляция предсердий носит семейный характер что наиболее вероятно обусловлено имеющимися генетическими нарушениями. Поэтому такую аритмию называют семейной формой фибрилляции предсердий. У всех оставшихся больных без патологии сердца аритмия трактуется как иди- опатическая (изолированная) форма фибрилляции предсердий.
У некоторых больных прослеживается наличие взаимосвязи между изменениями активности автономной нервной системы и возникновением пароксизма тахикардии. Влияние тонуса вагуса на ее возникновение демонстрируется следующими данными: 1) аритмия возникает в ночное время, во время отдыха, после еды или приема алкоголя; 2) ее возникновению предшествует прогрессирующее урежение синусового ритма; 3) частота ритма сердца во время пароксизма относительно небольшая; 4) пароксизмальная форма аритмии редко переходит в постоянную.
Такая вагусзависимая фибрилляция предсердий более характерна для т.н. идиопатической ее формы. Переносимость больным пароксизма аритмии относительно удовлетворительная, что обусловлено менее значительными нарушениями гемодинамики из-за небольшой частоты ритма. Применение бета-блокаторов или гликозидов может вызвать учащение приступов из-за угнетения тонуса адренергической системы или усиления тонуса вагуса.
Несколько реже определяется связь между пароксизмом фибрилляции предсердий и активацией симпато-адреналовой системы. Для таких случаев характерно: 1) возникновение приступов в дневное время; 2) провокация его стрессом (физическим, эмоциональным); 3) наличие полиурии во время пароксизма или после его купирования; 4) характерно возникновение аритмии на определенной (для конкретного больного) частоте синусового ритма; 5) высокая эффективность бета-блокаторов.
Фибрилляция предсердий, как правило, рецидивирует. Но если возникновение аритмии связано с острым заболеванием (например, инфаркт миокарда, эмболия легочной артерии) или острой травмой (операция на сердце или на других органах грудной полости), то успешное лечение основного заболевания обеспечивает предупреждение рецидива аритмии.
Электрокардиографические критерии диагностики:
- Отсутствие зубца Р.
- Беспорядочные аритмичные колебания волны f с частотой около 350 в 1 мин, которые лучше определяются в правых грудных отведениях.
- Различная продолжительность интервалов между желудочковыми комплексами и различия в высоте зубца R отдельных комплексов (рис. 19 Б).
В некоторых случаях волны f трудно распознаются (на фоне частого ритма желудочков, у больных хронической ишемической болезнью сердца) Форма желудочковых комплексов чаще остается неизмененной. Но при сочетании с нарушениями проводимости или на фоне очень частого ритма желудочков либо у больных инфарктом миокарда комплексы QRS становятся аберрантными. При очень больших различиях в длительности диастолических интервалов аберрация может возникать лишь в отдельных желудочковых комплексах, что требует дифференциации с желудочковой экстрасистол ией. Аберрат- ность проведения предполагается тогда, когда интервал сцепления такого комплекса с предшествующим неаберрантным меньше, чем между нормальными комплексами. Кроме того, такая вероятность увеличивается, если QRS имеет форму, характерную для блокады правой ножки пучка Гиса.
Высокая частота желудочкового ритма с уширенными комплексами QRS при фибрилляции предсердий может быть обусловлена проведением импульсов возбуждения по дополнительным путям или наличием блокады ножек пучка Гиса. Очень высокая частота ритма желудочков (более 200 уд. в
- мин) с большой вероятностью указывает на наличие дополнительного пути.
При тахикардии вследствие ишемии миокарда иногда снижается сегмент ST, образуются отрицательные зубцы Т.
Диагноз пароксизмальной мерцательной аритмии обычно не вызывает каких-либо трудностей, поэтому электрофизиологическое исследование для
|
-* * _ 4 |
- - * А . 4 \-\rt: 1 |
t Гг :Г;'. |
|
I |
:f.ngpl§ |
|
|
к |
1 * |
Г |
|
|
. /V |
|
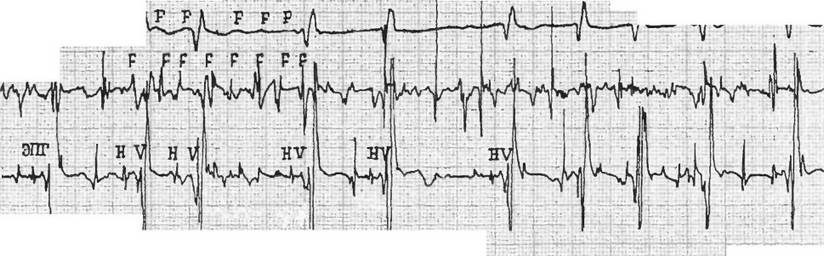
диагностики проводить необязательно. Лишь при необходимости дифференциации между желудочковой экстрасистолией и аберрантными комплексами следует провести регистрацию электрограммы пучка Гиса. Обнаружение потенциала пучка Гиса на гисограмме и нормальная продолжительного интервала HV позволяет утверждать, что желудочковые комплексы являются аберрантными, и, наоборот, отсутствие потенциала Н либо значительное укорочение интервала HV является характерным для желудочковых экстрасистол.
Фибрилляция предсердий у большинства сопровождается появлением неприятных ощущений (сердечные перебои, слабость), иногда очень тяжелыми проявлениями (гипотония, ишемия миокарда, ишемия мозга и даже потеря сознания). Но у небольшого числа больных может протекать бессимптомно, и возникновение тромбоэмболии, инсульта впервые демонстрирует наличие заболевания.
Обследование больных с фибрилляцией и трепетанием предсердий осуществляется с помощью следующих методов:
- Опрос с определением факторов, провоцирующих аритмию, частоты и продолжительности приступов, их переносимости, а также с целью выявления симптомов, характерных для других заболеваний (гипертире- оз, алкоголизм, гипокалиемия).
- ЭКГ покоя, Холтер ЭКГ (для выявления коротких пароксизмов, частоты экстрасистол, изменений ST-T).
- ВЭМ проба (роль физического и эмоционального стресса, выявление депрессии сегмента ST).
- Эхокардиография (определение наличия заболевания сердца, его функции).
- Анализ крови (для выявления воспалительных заболеваний, метаболических нарушений, эндокринных заболеваний, в частности, гиперфункции щитовидной железы).
- Транспищеводная эхокардиография (в случае необходимости определения тромбоза левого предсердия).
- Внутрисердечное электрофизиологическое исследование, картирование потенциалов (в случае необходимости проведение радиочастотной деструкции или хирургического лечения).
Фибрилляция предсердий нередко сочетается с наличием у больного других пароксизмальных аритмий, в частности, предсердной тахикардии и трепетания предсердий. Реже провоцируют ФП предсердно-желудочковая и АВ узловая пароксизмальные тахикардии. В процессе терапии антиаритми- ческими препаратами фибрилляция может превращаться в трепетание предсердий.
Трепетание предсердий. В настоящее время выделяют две формы трепетания: 1) типичную; 2) реверсивную типичную. Первая форма встречается наиболее часто (90% случаев). Путь ри-энтри в таком случае формируется в правом предсердии. Волна возбуждения распространяется против часовой стрелки сверху вниз по передней и боковой стенкам, а обратно - по перегородке. Вторая форма встречается редко (около 10% случаев) и характеризуется распространением волны возбуждения походу часовой стрелки по тем же анатомическим структурам правого предсердия. При трепетании предсердий циркуляция волны имеет характер макро-ри-энтри.
У больных с типичной формой трепетания на ЭКГ волны F в отведениях I, III, AVF отрицательные, а в Мг- положительные. При наличии типичной реверсивной формы характерным признаком является наличие отрицательных волн F в Vr
Ранее выделявшаяся атипичная форма трепетания предсердий представляет собой предсердную тахикардию с частотой сердечного ритма 240 и более в одну минуту, при которой предсердные комплексы имеют волнистую форму, но отличаются от характерных для типичной или типичной реверсивной форм трепетания. Этот ритм не стабильный, очень часто спонтанно прекращается или переходит в другую форму аритмии. В основе такой предсердной тахикардии могут быть различные механизмы ее возникновения: усиленный автоматизм, триггерная активность или микро-ри-энтри (очень малый круг циркуляции волн возбуждения). Эти особенности позволяют проводить дифференциальную диагностику с трепетанием предсердий.
Ранее использовавшееся разделение трепетания предсердий на 2 типа (первый и второй) представляется устаревшим. Первый тип по современной классификации - это типичная форма трепетания. Второй тип трепетания, при котором частота ритма достигает более 350 в мин, в настоящее время относится к предсердной тахикардии, которая очень нестабильна, и быстро замещается типичным трепетанием или фибрилляцией предсердий.
При трепетании предсердий частота проводимых на желудочки импульсов возбуждения зависит от электрофизиологических свойств атриовентрикулярного узла, степени активности симпатической и парасимпатической систем, влияния лекарственных препаратов.
Этиология. Трепетание предсердий, как правило, сочетается с органическим заболеванием сердца. Наиболее часто у таких больны
Источник: Мазур Н.А., «ПАРОКСИЗМАЛЬНЫЕ ТАХИКАРДИИ» 2005
А так же в разделе «Фибрилляция и трепетание предсердий »
- Предисловие
- Механизм возникновения аритмий
- Общие клинические методы обследования больных с подозрением на наличие пароксизмальной тахикардии
- Пароксизмальные наджелудочковые тахикардии
- Синусовая спонтанная тахикардия
- Синусоваяузловая реципрокная пароксизмальная тахикардия
- Фокальная (эктопическая) предсердная тахикардия
- Предсердная макро-ри-энтри тахикардия
- Предсердно-желудочковая узловая тахикардия
- Эктопическая (фокальная) тахикардия из атриовентрикулярного соединения
- Непароксизмальная реципрокная тахикардия из атриовентрикулярного соединения
- Пароксизмальная предсердно-желудочковая реципрокная тахикардия
- Желудочковые тахикардии
- Желудочковая тахикардия у больных без органического поражения сердца
- Синдром удлиненного QT (LQT)
- Синдром укороченного QT
- Аритмогенная правожелудочковая кардиомиопатия
- Синдром Бругада
- Трепетание и фибрилляция желудочков
- Внезапная смерть и ее профилактика
- Факторы риска возникновения фибрилляции желудочков у больных ИБС
- Профилактика ВСС у больных ИБС
- Гипертрофическая кардиомиопатия и риск ВСС
- Дилатационная кардиомиопатия, сердечная недостаточность и риск ВСС
- Клапанные пороки и риск внезапной смерти
- Аномалии отхождения коронарных артерий, мышечные мостики и риск внезапной смерти
- Нарушение функции проводящей системы сердца
- Внезапная смерть после аблации предсердно-желудочкового узла и после имплантации водителя ритма
- ВСС у людей со «здоровым» сердцем
- Реанимация в амбулаторных условиях
- Антиаритмические препараты
- Выбор антиаритмической терапии, её безопасность и эффективность при длительном лечении
- Литература
- Приложение Алгоритмы дифференциальной диагностики и выбора терапии