Механизм возникновения аритмий
Электрофизиология клеток миокарда и проводящей системы сердца. Микроэлектрод, введенный внутрь живой клетки миокарда, в состоянии покоя регистрирует небольшой отрицательный электрический потенциал, в то время как вне клетки потенциал имеет положительную величину. Этот так называемый трансмембранный потенциал покоя, или диастолический потенциал, в различных участках сердца неодинаков и колеблется от -50 до -95 мВ. Наличие потенциала покоя обусловлено 30-кратной разницей содержания ионов калия внутри клетки и во внеклеточной жидкости.
Во время возбуждения внутриклеточный потенциал становится на короткое время положительным и достигает почти +20 мВ, а затем постепенно возвращается к исходной величине. Это биоэлектрическое явление называется трансмембранным потенциалом действия, (рис. 1). Возбуждающий импульс от естественного водителя ритма или от искусственного источника электроэнергии уменьшает отрицательность потенциала покоя до определенного критического уровня, называемого пороговым потенциалом. Для большинства миокардиальных клеток он составляет около -65 мВ (цит. по В. Hoffman, P. Kreinfild, 1962). После достижения этого уровня отрицательный потенциал неудержимо уменьшается. Передача импульса (тока действия, потенциала действия) происходит от клетки к соседней клетке, которая до этого находилась в невозбужденном (недеполяризованном) состоянии. Изменения трансмембранного потенциала разделяют на пять фаз.
Фаза 0 представляет собой быстро протекающую деполяризацию клетки, т.е. уменьшение величины отрицательного внутриклеточного потенциала до нулевого значения, а затем переход его в положительный. Деполяризация клетки связана с увеличением проницаемости клеточной мембраны для ионов натрия, содержание которого внутри клетки в состоянии покоя значительно меньше, чем в межклеточной жидкости. В результате происходит очень быстрое выравнивание концентрации натрия по обе стороны клеточной мембраны путем переноса его по специальным каналам внутрь клетки. В это же время регистрируется медленный выход ионов калия из клетки. Вершина импульса совпадает с максимальной концентрацией натрия внутри клетки. В эту фазу, по некоторым данным, в клетку по кальциевым каналам поступает также небольшое количество ионов кальция.
Фазы 1-3 представляют стадию реполяризации клетки, которая наступает сразу после деполяризации. Фаза 1 - ранняя быстрая реполяризация - на рис. 1 проявляется коротким участком кривой, направленной круто вниз.
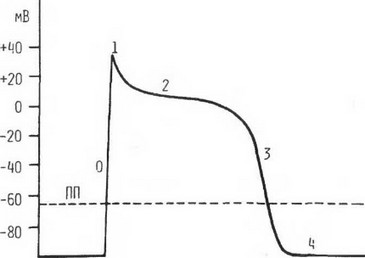
Рис. 1. Трансмембранный потенциал клетки миокарда желудочков:
О - фаза быстрой деполяризации; 1 - фаза ранней быстрой деполяризации; 2 - плато или медленная деполяризация; 3 - заключительная фаза реполяризации; 4 - потен- циал покоя. ПП - пороговый потенциал
Возникновение этой фазы обусловлено быстрым переносом через каналы внутрь клетки ионов хлора.
Фаза 2 реполяризации, или плато,характеризуется относительно медленно протекающим процессом восстановления отрицательного внутриклеточного потенциала. Эта фаза регистрируется во всех клетках миокарда и проводящей системы сердца, за исключением синусового и атриовентрикулярного узлов. Образование плато объясняется в основном медленным переносом в клетку ионов кальция и частично натрия, а также продолжающимся вхождением калия. В течение этой фазы вне клетки имеется высокая концентрация ионов кальция и натрия. Плато потенциала действия переходит в фазу 3, представляющую вновь быстро нарастающий отрицательный потенциал. В эту фазу содержание внутриклеточных ионов, особенно калия, достигает уровня характерного для потенциала покоя.
Все три фазы реполяризации хорошо выделяются в пучке Гиса, волокнах Пуркинье, миокардиальных волокнах предсердий и желудочков. В клетках синусового и предсердно-желудочкового узла различить их невозможно, так как они плавно переходят друг в друга (рис. 2).
Фаза 4 (потенциал покоя, диастолический потенциал) регистрируется во всех возбудимых структурах сердца, за исключением клеток водителей ритма, в виде горизонтальной линии, отражающей, по-видимому, сбалансированность переноса ионов в обоих направлениях. В клетках водителя ритма сердца на протяжении всего диастолического периода постепенно умень-
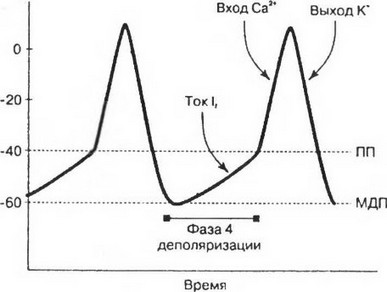
Рис. 2. Генерация потенциала действия в клетках-пейсмекерах. Фаза медленной деполяризации (фаза 4) обусловлена пейсмекерным током (If), который уменьшает отрицательный мембранный потенциал до величины порогового потенциала (около - 40мВ). Быстрое начало потенциала действия связано с медленным входом ионов Са+*в клетку. Закрытие кальциевых каналов и выход К* из клетки сопровождается реполяризацией мембраны. МДП - максимальный диастолический потенциал; ПП - пороговый потенциал
шается потенциал покоя, что обусловлено выходом из этих клеток небольшого количества калия. Такое постепенное уменьшение потенциала покоя получило название медленной спонтанной деполяризации, которая продолжается до тех пор, пока уменьшение величины трансмембранного потенциала не достигнет уровня порогового потенциала. Именно медленная спонтанная деполяризация является основным электрофизиологическим механизмом, обеспечивающим функцию автоматизма синусового узла.
Фаза 0 деполяризации в клетках синусового и предсердно-желудочкового узла протекает более медленно, чем в других тканях сердца, что связано с замедленным током ионов. Однако в очагах повреждения миокарда может произойти частичная деполяризация мембраны клеток, инактивация переноса ионов натрия, и они приобретают свойства медленно деполяризующихся клеток или клеток с медленным ответом. В результате образуется эктопический очаг возбуждения. Кроме того, ткани с зависимой от медленного тока ионов фазой 0 деполяризации предрасположены к возникновению однонаправленной блокады проведения импульса, что является одним из условий для повторного входа волны возбуждения и возникновения тахикардий.
Таким образом, в настоящее время большое значение для возникновения нарушений ритма придается натриевой системе (натриевые каналы, перенос ионов натрия через клеточную мембрану), а также медленному току ионов внутрь клетки. Исходя из этих представлений, аритмии могут быть прерваны при дальнейшем угнетении натриевой системы, при подавлении медленного тока ионов внутрь клетки в эктопическом очаге либо в результате реактивации натриевой системы (Arnsdorf M.F., 1977).
Возникновение аритмии может быть обусловлено нарушением образования импульса возбуждения, нарушением проведения возбуждения или наличием комбинаций указанных двух вариантов нарушения.
Нарушение образования импульса или нарушение автоматизма является следствием уменьшения максимального диастолического потенциала в клетках миокарда предсердий, желудочков или проводящей системы сердца. Такая частичная деполяризация клеток создает условия для появления эктопического импульса из этих клеток. В клинике с нарушением автоматизма связывают возникновение выскальзывающего ритма из предсердий (тахикардия, вызываемая гликозидами), ускоренного ритма из атрио-вентрикулярного соединения, идиовентрикулярного ритма, а также парасистолии. Автоматизм в эктопическом очаге возникает спонтанно, т.е. не провоцируется извне.
Триггерная активность является результатом возникновения эктопического очага возбуждения, вызванного достигшим этого участка импульсом. Этим данная пейсмекерная активность отличается от нарушенного автоматизма.
Деполяризация в очаге триггерной активности может наступить до или после полной реполяризации клеток и соответственно называется ранней или замедленной постдеполяризацией.
Ранняя постдеполяризация возникает в фазу 2 или фазу 3 потенциала действия. Замедленная или поздняя постдеполяризация генерируется в фазу 4 потенциала действия (рис. 3,4).
Ранняя постдеполяризация может возникнуть в результате увеличения внутриклеточного положительного заряда. Предполагается, что в этих случаях нарушается транспорт ионов через L-тип кальциевых каналов. Ранняя постдеполяризация, возникающая в фазу 2 потенциала действия, является результатом времязависимой и вольтажзависимой реактивации этих каналов мембраны клеток. Этот вид эктопической активности преимущественно наблюдается в клетках Пуркинье и в М клетках миокарда желудочков.
В клинике ранняя постдеполяризация может быть повинна в возникновении желудочковой тахикардии типа пируэт и удлинения интервала QT у больных, получающих некоторые антиаритмические препараты (хинидин, ами- одарон, соталол) и другие средства (эритромицин, пробукол и многие другие).
Ранняя постдеполяриэация
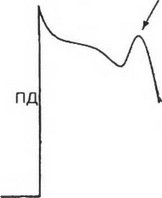

Рис. 3. Триггерная активность. Ранняя постдеполяризация (указана стрелкой) наблюдается еще до полной реполяризации потенциала действия (ПД). Частые повторные постдеполяризации (пунктирная кривая) могут генерировать частые потенциалы действия и приводить к возникновению тахикардии
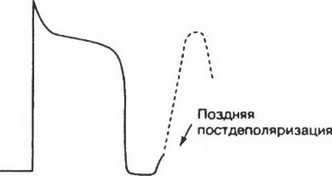
Поздняя (замедленная) постдеполяризация, как механизм возникновения аритмий, была продемонстрирована в экспериментальных условиях с использованием миофибрил, взятых из предсердий, желудочков, волокон Пуркинье и размещенных в перфузируемом растворе, который не содержал ионов натрия или в растворе, содержащим препараты дигиталиса. Имеются данные, которые позволяют предполагать, что ускоренный идиовентрику-
лярный ритм после инфаркта миокарда, может быть обусловлен возникновением поздней постдеполяризации.
Поздняя постдеполяризация появляется в результате возникновения преходящего направленного внутрь клетки тока, который в нормальных физиологических условиях отсутствует или выражен в очень малой степени. Появление этого тока можно спровоцировать с помощью избыточной стимуляции симпатикуса, что приводит к перегрузке клеток кальцием. Поэтому данная форма триггерной активности успешно подавляется антагонистами кальция, бета-адреноблокаторами.
Ри-энтри тахикардия, также как аритмия, возникшая по триггерному механизму, провоцируются и подавляются отдельными электростимулами, что не позволяет провести дифференциальную диагностику между ними. И только, в отличие от ри-энтри тахикардии, последняя подавляется электростимуляцией, проводимой с большей частотой, чем частота эктопического ритма.
Ри-энтри (повторный вход или циркуляция волны возбуждения). Для возникновения аритмии по механизму ри-энтри необходимо наличие трех основныхусловий: 1) два пути проведения возбуждения, разделенные между собой функционально или анатомически; 2) блокада проведения импульса по одному из путей; 3) восстановление проводимости в определенный отрезок времени либо сохранение проводимости лишь в ретроградном направлении.
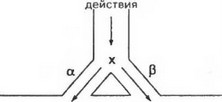
На рис. 5 схематически представлено возникновение механизма ри-энтри в предсердно-желудочковом узле, а также при наличии дополнительного пучка Кента. Показано, что импульс в антероградном направлении проводится лишь по одной части волокон узла и блокируется в другой. При достижении дистальной части блокированного участка импульс дальше ан- тероградно распространяется по всему проводящему тракту. Кроме того, при восстановлении к этому времени проводимости в ранее блокированном участке импульс с меньшей скоростью проводится по нему в ретроградном направлении.
При достижении его проксимальной части импульс распространяется дальше как в ретроградном, так и в антероградном направлении вследствие того, что эта часть узла вновь приобретает свойство возбуждаться. Так образуется замкнутый круг, по которому циркулирует импульс возбуждения, что приводит к возникновению тахикардии. Однонаправленная блокада объясняется возникновением в этом участке декрементного или неоднородного проведения, либо она возникает в результате увеличения продолжительности рефрактерного периода.
Потенциал
|А | Норма
Дистальные отделы проводящей системы
Односторонняя
блокада
Нормальная скорость
fjgj ретроградного
проведения
импульсов
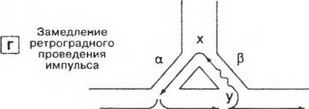
Рис. 5. Механизм повторного входа волны возбуждения (re-entry):
а - проведение импульса в норме. Распространяясь по проводящей системе, импульс достигает точки «х» и далее следует по двум параллельным путям (а и Р) в нижерасположенные участки; б - односторонняя блокада. Проведение по пути р блокировано, поэтому импульс может нормально распространятся только по пути а. Достигнув точки «у», импульс ретроградно проводится по пути а; в - импульс возвращается в точку «х», и если путь а пока еще не способен активироваться (после предыдущего импульса), то повторная волна возбуждения просто затухает; г - если скорость ретроградного проведения невелика, и время, за которое импульс проходит по пути Р достаточно для полной реполяризации пути ос, то, достигнув точки «х», импульс вновь активирует путь а, замыкая круг, по которому постоянно циркулирует волна возбуждения
Такое функциональное разделение предсердно-желудочкового узла на два пути проведения возбуждения получило название продольной функциональной его диссоциации. Вместе с тем некоторые особенности разветвлений в системе Гиса-Пуркинье, так же как и наличие дополнительных путей проведения импульса, создают анатомические предпосылки для развития механизма ри-энтри. Например, у больных с дополнительным пучком Кента круг циркуляции импульса возбуждения, кроме дополнительного пути, включает предсердия, предсердно-желудочковый узел и одну из ножек пучка Гиса.
Источник: Мазур Н.А., «ПАРОКСИЗМАЛЬНЫЕ ТАХИКАРДИИ» 2005
А так же в разделе «Механизм возникновения аритмий »
- Предисловие
- Общие клинические методы обследования больных с подозрением на наличие пароксизмальной тахикардии
- Пароксизмальные наджелудочковые тахикардии
- Синусовая спонтанная тахикардия
- Синусоваяузловая реципрокная пароксизмальная тахикардия
- Фокальная (эктопическая) предсердная тахикардия
- Предсердная макро-ри-энтри тахикардия
- Предсердно-желудочковая узловая тахикардия
- Эктопическая (фокальная) тахикардия из атриовентрикулярного соединения
- Непароксизмальная реципрокная тахикардия из атриовентрикулярного соединения
- Пароксизмальная предсердно-желудочковая реципрокная тахикардия
- Фибрилляция и трепетание предсердий
- Желудочковые тахикардии
- Желудочковая тахикардия у больных без органического поражения сердца
- Синдром удлиненного QT (LQT)
- Синдром укороченного QT
- Аритмогенная правожелудочковая кардиомиопатия
- Синдром Бругада
- Трепетание и фибрилляция желудочков
- Внезапная смерть и ее профилактика
- Факторы риска возникновения фибрилляции желудочков у больных ИБС
- Профилактика ВСС у больных ИБС
- Гипертрофическая кардиомиопатия и риск ВСС
- Дилатационная кардиомиопатия, сердечная недостаточность и риск ВСС
- Клапанные пороки и риск внезапной смерти
- Аномалии отхождения коронарных артерий, мышечные мостики и риск внезапной смерти
- Нарушение функции проводящей системы сердца
- Внезапная смерть после аблации предсердно-желудочкового узла и после имплантации водителя ритма
- ВСС у людей со «здоровым» сердцем
- Реанимация в амбулаторных условиях
- Антиаритмические препараты
- Выбор антиаритмической терапии, её безопасность и эффективность при длительном лечении
- Литература
- Приложение Алгоритмы дифференциальной диагностики и выбора терапии