ГЛАВА 8 ЭВОЛЮЦИЯ ИДЕЙ АКАДЕМИКА В.Д. БЕЛЯКОВА О САМОРЕГУЛЯЦИИ ПАРАЗИТАРНЫХ СИСТЕМ В КОНЦЕПЦИИ ИНТЕГРАЦИОННО-КОНКУРЕНТНОГО РАЗВИТИЯ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
История развития любой науки показывает, что наибольший вклад в познании предмета исследования достигается учеными тогда, когда они отходят от привычного взгляда на суть явления и разрабатывают новые методы исследования и новые теории познания. В развитие эпидемиологии последних десятилетий XX века весомый вклад внес академик В.Д. Беляков, сумевший отойти от традиционного понимания механизма развития эпидемического процесса и, преодолевая колоссальное сопротивление консервативного большинства, внедрить идеи саморегуляции паразитарных систем в науку и практику, тем самым стимулируя творческую мысль других ученых [1].
При всей самодостаточности указанной теории, она, тем не менее, базировалась на традиционном постулате инфекционноиммунологических отношений между микробом и организмом человека. Однако всегда ли и при всех инфекциях иммунитет является регулирующим механизмом, препятствующим их распространению? При инфекциях наружных кожных покровов, желудочнокишечного тракта (за исключением энтеровирусных, в частности полиомиелита), кровяных (трансмиссивных) антропонозах тормозящее влияние популяционного иммунитета на развитие эпидемического процесса обычно не сказывается, поскольку число (относительное число) иммунных недостаточно для реального влияния на циркуляцию паразита [2]. Антитела как наиболее специфическая форма иммунного реагирования на инфекционные агенты часто не отражают состояние невосприимчивости (стерильного иммунитета), а являются лишь индикаторами иммунологической реактивности. По мнению А.А. Сохина [3], инфекционный иммунитет - не столько способ уничтожения и выведения, сколько один
173
из способов (сохранения) поддержания популяции возбудителя в организме биологического хозяина в форме, выгодной для обоих взаимодействующих видов. По-видимому, нестерильный иммунитет и связанное с ним бактерио- и вирусоносительство являются широко распространенной формой иммунитета к инфекционным заболеваниям в природе [4]. Сама реакция макроорганизма против патогенного микроба, так же как реакция микроба против хозяина по своей биологической сущности - взаимо приспособительная [5]. Поэтому инфекционная болезнь - это не борьба до победного конца, а своеобразный процесс приспособления, заканчивающийся чаще всего новой формой симбиоза организма и микроба. Сущность инфекционной болезни - это иммуногенез и выработка новых взаимоотношений эндосимбионта на новом, более высоком уровне защитных особенностей организма хозяина.
Необходимо подчеркнуть, что аргументация теории саморегуляции в основном базируется на микробиологических исследованиях и в ней весьма детально отражены все фазы развития микроорганизма как в отдельном организме в ходе развития инфекционного процесса, так и в популяции в целом - в ходе развития процесса эпидемического [6]. Целенаправленных иммунологических исследований в этом плане мы не встретили, а все возможные изменения степени восприимчивости популяции в связи с циркуляцией того или иного возбудителя априори базировались на существующих взглядах на иммунный ответ как в отдельном организме, так и в популяции человека в целом. При этом позднее сам В.Д. Беляков с соавт. [1] отмечали, что «...движение информации как в вертикальном, так и горизонтальном направлении за счет закрепления программ изменчивости, индуцированных реакций и переноса генов позволяет популяции микроорганизмов выступать как интегрированное целое, аналогичное гигантскому многоклеточному организму», т.е. популяция реагирует на различные влияния извне не формированием иммунитета, а «движением информации» [1]. Созвучно этому и мнение Е.И Болотина с соавт. [7], считающих, что «.антропонозные инфекции формируют антропоэкологические системы, центральным элементом которых выступает человек. Их размеры изменяются в широком диапазоне - от индивидуальной микросистемы, образуемой отдельным 174 человеком, до глобальной макросистемы, включающей все население Земли. При этом все сферы существования микроорганизмов имеют коммуникационные связи, в частности обеспечивающие движение между ними генетической информации».
Правомерность таких суждений подтверждают исследования ученых Массачусетского технологического института (США), показавших, что взаимодействие микроорганизмов можно сравнить со всемирной генетической сетью, внутри которой постоянно циркулирует важная генетическая информация. При этом генами обмениваются совершенно далекие друг от друга группы бактерий: некоторые из них, по данным исследователей, отличаются друг от друга, как дрожжевой грибок от человека. Возможные способы обмена генами между бактериями: с помощью вирусов, вне хромосомных плазмидных ДНК или просто через ДНК от мёртвой клетки [8]. Перенос генетического материала между отдаленно родственными видами микроорганизмов рассматривается как естественный процесс, обеспечивающий их адаптацию и выживание в меняющемся микро- и макромире.
Важно также подчеркнуть, что с позиций теории саморегуляции паразитарных систем В.Д. Беляковым объяснялась и природа цикличности инфекционных болезней. Однако формирование популяционного иммунитета как фактора влияющего на динамику инфекционных болезней, в большей мере характерно для инфекций с воздушно капельным путем передачи [2], тогда как цикличность как явление присуща практически всем инфекциям [9]. Однако и В.Д. Беляков с соавт. впоследствии пришли к следующему заключению «.. .не будет вульгаризацией считать, что микроорганизмы, живущие в человеческих коллективах, сами создали себе сезонные и циклические колебания инфицированности» [10].
Все вышеизложенное, по нашему мнению, свидетельствует о том, что к объяснению явления саморегуляции паразитарных систем следует подходить и с других позиций. В частности, теория саморегуляции не учитывала того обстоятельства, что филогенез возбудителей инфекционных болезней проходил в условиях тесного и избирательного взаимодействия отдельных видов. В орга-
175
низме хозяина и во внешней среде микроорганизмы сформировали различные биоценозы, постоянно подвергаясь в них влиянию абиотических и биотических факторов. Сложившиеся взаимоотношения между сочленами биоценоза могут быть и интеграционными (сотрудничество), и конкурентными, что, несомненно, сказывается и на проявлениях ЭП [11-14].
В этой связи среди биологов прежде всего зреет понимание того, что следует изучать не закономерности жизнедеятельности отдельных видов животных, растений или микроорганизмов, а необходимо проводить сопряженный анализ, направленный на оценку всех субъектов, формирующих биоценоз (биогеоценоз) [15, 16]. По-мнению И.И. Шмальгаузена [16], именно биоценоз выступает по отношению ко всем составляющим его популяциям видам как управляющее устройство. Его самонастройка составляет основу приспособленности видов к среде обитания и взаимного приспособления их друг к другу. Следовательно, к оценке саморегуляции, как мы полагаем, следует подходить не только изучая механизмы, способствующие саморегуляции в отдельной паразитарной системе, но и с позиций биоценотических, направленных на изучение механизмов, обусловливающих саморегуляцию всей антропоэкологической системы - т.е. «...единого пространственно-временного образования, способного занимать географическую территорию любого масштаба и включающую весь комплекс патогенов в человеческой популяции» [7]. При этом антропоэкологическую систему следует рассматривать как составную часть биогеоценоза, в который помимо этой системы входит мир животных, растений и других микроорганизмов, не затрагивающих человеческую популяцию.
Однако в эпидемиологии традиционно принято изолированно рассматривать ЭП любой инфекции. Существующие в настоящее время теории эпидемиологии не принимают во внимание возможность интеграционно-конкурентных взаимоотношений между микроорганизмами в антропоэкологической системе, а в эпидемиологических исследованиях, как правило, не дается оценка возможному отражению этих взаимоотношений на популяционном уровне. Между тем сопряженная эволюция паразитизма и патогенности постоянно переплеталась на всех уровнях развития 176 живой материи - от растений и даже микроорганизмов (болезни бактерий) до беспозвоночных (от простейших до членистоногих), позвоночных животных (рыб, земноводных, птиц и млекопитающих) а также вида Homo sapiens [12]. Постоянное взаимодействие потенциально патогенных для людей (животных) микроорганизмов с макроорганизмами сопровождается антагонистическими (конкуренция) и синергетическими (интеграция) отношениями между сочленами паразитарных систем из-за острой конкуренции среди паразитов за чувствительные организмы хозяев, а в последних - за чувствительные ткани [17]. По мнению А.А. Селиванова [18] конкурентные или интеграционные взаимоотношения между возбудителями могут возникать как при непосредственном взаимодействии, так и опосредовано: через иммунную систему хозяина или на межпопуляционном уровне. При этом бактерии и вирусы, видимо, способны влиять на вирулентность друг друга [19]. В подтверждение вышесказанному, при анализе литературных публикаций, нами было отмечено, что вирус гриппа А, взаимодействуя с возбудителем скарлатины и других стрептококковых инфекций - бета-гемолитическим стрептококком группы А (БГСА), или Streptococcus pyogenes, повышает вирулентность последнего [20]. К сожалению, методические подходы к изучению результатов взаимоотношений между микроорганизмами на популяционном уровне не разработаны. Как мы полагали, возможность и эпидемиологические последствия указанных взаимодействий легче проследить в закрытых коллективах, где ЭП относительно автономен, а спектр потенциальных патогенов беден. В частности, проводимые нами исследования в рамках морской эпидемиологии позволили установить, что при сочетанном выделении в ходе рейса от моряков вирусов гриппа А и БГСА или аденовирусов и БГСА, штаммы БГСА обладали более высокой гидрофобностью, косвенно свидетельствующей об их высокой вирулентности [21]. Следовательно, и вирусы гриппа А, и аденовирусы способны повышать вирулентность БГСА.
Общеизвестно, что вирусы «открывают дорогу» бактериям. Однако и бактерии способны влиять на развитие ЭП вирусной инфекции. Так БГСА обладает антиинтерфирирующим действием и влияет на выработку антител к респираторным вирусам [22].
177
Приведенные материалы результатов экспериментальных исследований указывали на вероятность интеграционно-конкурентных взаимоотношений между БГСА и респираторными вирусами (РВ). Принимая во внимание многоуровневый характер ЭП [23, 24], это явление, как мы полагаем, должно найти отражение в проявлениях ЭП инфекций, вызываемых данными возбудителями (грипп, ОРЗ, ангина, скарлатина), и, прежде всего, в динамике заболеваемости и ее уровне.
Эпидемиологическая оценка результатов сопряженного ретроспективного анализа динамики заболеваемости ОРЗ и ангиной моряков и рыбаков в ходе рейса на 11 судах (плавбазы, плавзаводы) со средней численностью экипажа 280-450 чел. за 1983-1991 гг. показала, что ЭП указанных нозоформ не совпадал по фазе своего развития. Для направленности их динамики заболеваемости была характерна обратная корреляционная связь средней силы (г = 0,4-0,6). Кроме того, значительное превышение среднерейсового уровня заболеваемости ОРЗ не сопровождалось подобными изменениями показателей для ангины (рис. 8.1). Аналогичные сведения, указывающие на последовательную цикличность проявлений ЭП этих заболеваний в коллективе, с учетом одновременной циркуляции РВ и БГСА в последующем мы нашли и у других исследователей [25].
В ходе длительного промыслового рейса (около 7 мес. без захода в порты) на рыбомучной базе «Е. Лебедев» в 1991 г. нами проводились бактериологические, вирусологические и иммунологические исследования, направленные на изучение механизмов формирования заболеваемости респираторной стрептококковой инфекции у членов экипажа [26]. В результате исследований установлено, что ведущими факторами, способствующими активизации ЭП в ходе рейса, являются «выход в море и первый месяц плавания» и «3-4-й месяц пребывания в рейсе». Именно эти факторы риска приводят к формированию внутри рейсовых подъемов заболеваемости ОРЗ и ангиной в длительном плавании без захода судна в порты. Анализ динамики этих подъемов заболеваемости по пятидневкам рейса на судах разного типа позволил установить, что практически во всех случаях рост числа заболевших в первую пятидневку начинался с ОРЗ, предваряя последующий рост заболеваемости членов экипажа ангиной. Затем вновь нарастала заболеваемость ОРЗ с последующим ее прекращением или проявлением спорадическими случаями (рис. 8. 2).
Сопоставление приведенных выше материалов с соответствующими данными литературы [11], подтверждало наше предположение о возможности реализации интеграционно-конкурентных взаимоотношений между РВ и БГСА на локальном уровне развития ЭП.
В свете представленных данных механизм развития ЭП указанных инфекций в рейсе можно интерпретировать следующим образом. В результате действия вышеназванных факторов риска у членов экипажа происходит изменение иммунного статуса, способствующее активизации, наиболее выражено проявляющей себя в закрытых коллективах аденовирусной инфекции [11], т.е. трансформации ее из состояния носительства в манифестную форму, что и проявляется возникновением случаев ОРЗ (см. гл. 4). Распространение аденовирусов в коллективе способствует повышению вирулентности циркулирующих здесь БГСА, создает предпосылки к становлению эпидемического варианта пиогенного стрептококка и развитию последующей фазы ЭП - эпидемическому распространению [1], приводя к заболеванию ангиной. Кроме того, ОРЗ интенсифицируют механизм передачи БГСА [27]. Постепенное ограничение циркуляции БГСА (соответственно снижение активности ЭП) обусловлено формированием типоспецифического к данному штамму стрептококка иммунитета. В то же время, как мы указывали выше, БГСА обладают антиинтерфирирующим действием и способны ингибировать выработку антител к РВ, поэтому они, в свою очередь, активизируют ЭП респираторных вирусов с последующим нарастанием ОРЗ. Впрочем, и их распространение так же ограничивает формирующийся у членов экипажа коллективный иммунитет. Поскольку известно, что развитие ЭП заканчивается при наличии определенного потенциала неиммунных лиц [1], то, как мы полагаем, наряду с формированием иммунитета к соответствующему РВ, определенное ограничивающее влияние на их распространение оказывают и БГСА. Последние, в этой ситуации, вступают уже в конкурентные взаимоотношения с РВ. Не исключено, что ограничивающее влияние БГСА на ЭП РВ связано с секреторными иммуноглобулинами слюны, которые, препятствуя адсорбции антигенов на слизистых, таким образом, ингибируют наиболее важную адгезивную стадию инфекционного процесса. Кроме того, секреторные иммуноглобулины способны нейтрализовать вирусы, которые находятся внутри эпителиальных клеток, в момент их перемещения с базальной к апикальной поверхности слизистых [28].
Следовательно, активизация эпидемического процесса и его угасание возможны не только вследствие реализации инфекционно-иммунологического механизмов, но и в результате воздействия паразитарной системы одной инфекции на паразитарную систему другой. В соответствии с представленной концепцией интеграционно-конкурентного развития ЭП, инфекции, имеющие общую локализацию и/или механизм передачи, могут влиять (активизировать или тормозить) на развитие ЭП друг друга. Как мы полагаем, благодаря интеграционно-конкурентным взаимоотношениям, становится возможным поддержание одновременной циркуляции и длительного сохранения различных паразитических видов в условиях ограниченных ресурсов обитания.
Выявленные нами на локальном уровне ЭП интеграционноконкурентные взаимоотношения РВ и БГСА, позволяют предполагать, что они могут проявиться и на региональном уровне. С этой целью мы сопоставили многолетнюю динамику заболеваемости скарлатиной и гриппом населения Владивостока. Выбор именно этих нозоформ обусловлен тем, что возникновение заболеваний скарлатиной свидетельствует о циркуляции среди населения наиболее вирулентных штаммов БГСА. Подъем заболеваемости гриппом отражает фазу эпидемического распространения этой инфекции [1]. Как показали результаты анализа, пики заболеваемости скарлатиной и эпидемических вспышек гриппа среди населения Владивостока носили разнонаправленный характер и не совпадали (рис. 8.3).
Важно отметить, что и годовая динамика заболеваемости скарлатиной в период эпидемий гриппа и вне их существенно разнилась. При этом прежде всего изменялась интенсивность весеннего подъема скарлатины: в межэпидемический по гриппу период пик заболеваемости был значительно выше, чем в эпидемический (рис. 8.4).
Следовательно, интеграционно-конкурентные взаимоотношения между РВ и БГСА проявляются и на региональном уровне развития ЭП. С эволюционных позиций эти результаты вполне объяснимы, ибо одновременная циркуляция среди населения (причем, преимущественно детского) высоковирулентных штаммов БГСА и гриппа способна оказать неблагоприятное влияние на его жизнедеятельность. Имеющиеся наблюдения свидетельствуют об усилении летального эффекта от стрептококковой инфекции, даже в случае инфицирования авирулентным вариантом, если этому предшествовало заболевание гриппом [20]. Следует заметить, что аналогичные результаты нами получены и при интеграционном подходе к изучению эпидемиологии гепатитов В и С, ВИЧ- инфекции и парентеральных гепатитов, дизентерии и гепатита А [29-31].
Выявленные интеграционно-конкурентные взаимоотношения в развитии ЭП вполне закономерны. Известно, что ни одна из его фаз не дает возбудителю возможность сохраняться как виду [1]. Их чередование, постоянная смена одного возбудителя другим позволяют адаптироваться, проявить патогенность и существовать каждому из них. В этой связи важно подчеркнуть, что исследователями давно замечено, что инфекции с одинаковым механизмом передачи и первичной специфической локализацией не совпадают по фазе своего развития [32]. По справедливому замечанию Г.П. Надарая [33], одному из первых применивших интеграционный подход к изучению ЭП различных инфекций, «.. .есть всеобщая согласованность закономерности совместного распространения инфекций, и она - атрибут их далекого эволюционного прошлого». Правомочность таких суждений подтверждают достижения микробиологии за последние десятилетия, которые показали, что бактерии для своего выживания, так же как и люди, широко используют преимущества, которое дает коллективное поведение [34]. Однако, если такое поведение доказано для бактериального сообщества, то оно вполне вероятно и для взаимоотношений между вирусами и бактериями, или вирусами и простейшими и т.п. Как мы полагаем, «договоренность» может реализовываться и через интеграционно-конкурентные механизмы взаимодействия. Все это «.обусловлено эволюционной мудростью природы, спо- 184 собствующей наиболее рациональному использованию иммунного потенциала населения с целью сохранения как непосредственного хозяина, так и паразита» [33].
Таким образом, представленные нами результаты исследований свидетельствуют о том, что саморегуляция присуща не только отдельно взятой паразитарной системе, но и антропоэкологической системе в целом. При этом основными механизмами саморегуляции наряду с инфекционно-иммунологическими будут и интеграционно - конкурентные взаимоотношения между видами, поскольку именно они обеспечивают стабильность существования любых систем [35]. Как мы полагаем, главным связующим звеном между различными антропопаразитарными системами в биогеоценозе являются вирусы. Во-первых, именно они влияют на вирулентность бактерий, способствуя их выходу из фазы резервации, и тем самым играют триггерную роль в развитии ЭП. Во-вторых, наряду с внехромосомными плазмидными ДНК, вирусы обеспечивают обмен генами между бактериями [8]. В этой связи нельзя не привести мнение К.Г. Уманского [36], считающего вирусы вездесущими и необходимыми звеньями биосферы, роль которых (в основном) сводится к участию в адаптационных процессах, причем не только к адаптации к условиям среды обитания, но и к взаимной адаптации различных организмов в среде обитания, а также в процессах репарации и регенерации и, наконец, в эволюции в целом.
Следует заметить, что в эпидемиологической литературе часто встречается понятие «экологическая сбалансированность» [37]. Считается, что каждая из инфекций имеет свою экологическую нишу и ее освобождение вследствие, например, проводимых противоэпидемических мероприятий, способно привести к занятию ее новыми, ранее не встречающимися, инфекциями. В этом плане в литературе по экологии [38] приводится следующий пример: «любое сообщество можно представить себе как «-мерное пространство, занимаемое экологическими нишами разных видов. При диффузной конкуренции каждый вид взаимодействует с множеством других, конкурируя с ними по разным факторам среды. Успех или неудача закрепления вида в сообществе в первую очередь зависят от отношения конкуренции и эксплуатации с другими
185
видами. Представьте себе ящик, заполненный надутыми воздушными шариками: каждый из них давит на все остальные. Если популяция какого-то вида (шарик) «проиграет», то есть не сможет себя воспроизводить (лопнет), эффект от ее исчезновения приведет к сдвигу равновесия между всеми остальными популяциями (перемещению остальных шариков)». Как мы полагаем, такая сбалансированность может быть реализована только вследствие интеграционно - конкурентного взаимодействия между отдельными видами микроорганизмов.
Таким образом, инфекционно-иммунологические и интеграционно-конкурентные взаимоотношения - два дополняющих друг друга механизма, обусловливающих саморегуляцию антропоэкологической системы в биогеоценозе. Тем не менее важную контролирующую и регулирующую роль в развитии ЭП, способствующую реализации указанных механизмов, играют природные и социальные факторы (см. гл. 3). Как показывают результаты наших исследований и данные других авторов, в большей степени их влияние проявляется на локальном и региональном уровнях ЭП, тогда как на глобальном решающее значение имеет фактор (или факторы), способствующий формированию цикличности (см. гл. 5 [39]).
Следует заметить, что при эпидемиологической оценке указанного проявления ЭП, как правило, рассматриваются причины и условия, приводящие к одновременному подъему заболеваемости, тогда как ее снижение, преимущественно, объясняется проведением противоэпидемических мероприятий, нивелирующих возможность реализации механизма передачи инфекта. Несомненно, на локальном, да и на региональном уровнях ЭП, указанный фактор играет значимую роль, что находит свое отражение, прежде всего, в формировании определенного ординара заболеваемости в регионе и особенностях ЭП. Однако в глобальном аспекте следует учитывать тот факт, что любая биологическая система, а к ней, несомненно, относится и паразитарная, в своем развитии тратит энергию, что, на наш взгляд, и приводит к переходу возбудителя в фазу резервации или в организме человека в виде носительства, или к формированию ¿-форм и некультивируемых форм бактерий, а также биопленок или, возможно, даже - к резервации в популяции животных (например, вируса гриппа), поскольку микроор- 186
ганизмы, видимо, хорошо «понимают», что «прекрасный способ разбазаривания энергии - делать больше копий самого себя» [40]. В конечном итоге именно это явление, как мы полагаем, проявляется снижением заболеваемости.
Все вышеуказанные преобразования микроорганизмов направлены на длительное сохранение возбудителя в покоящемся состоянии и соответственно на формирование межэпидемического периода. К сожалению, какие факторы способствуют в последующем выходу микроорганизма из состояния покоя к активизации, мы доподлинно не знаем и можем лишь предполагать (см. гл. 5). По мнению В.М. Шубика, наличие сложных взаимоотношений в системе паразит - хозяин и большого числа связей между каждым из членов этой экосистемы и остальными членами биогеоценоза крайне затрудняет предвидение реакций всей этой сложной многозвенной системы (биогеоценоза) на внешние и внутренние воздействия. Существенное влияние на эти системы оказывают в настоящее время массовые противоэпидемические мероприятия, в частности профилактические прививки, широкое применение антимикробных препаратов и т.п. Все это дает основание предполагать наличие некоторой неустойчивости в системах паразит-хозяин и особую их чувствительность к действию новых экологических факторов [41]. Поэтому чрезвычайно сложно прогнозировать активизацию тех или иных инфекций, угрожающих или потенциально способных угрожать населению планеты.
В частности, генеральный директор Всемирной организации здравоохранения Маргарит Чен в одном из своих выступлений отметила, что риск возникновения масштабной эпидемии лихорадки Эбола в 2014 г. был недооценен. Но располагаем ли мы сегодня какими-то либо объективными критериями, способными спрогнозировать такую возможность? К сожалению, нет. Имеющиеся в современный период различные прогностические модели не учитывают всей сложности взаимосвязей между микроорганизмами в биогеоценозе. Поэтому прогноз развития той или иной эпидемиологической ситуации так же сложен, как, например, прогноз возникновения землетрясений и прочих катаклизмов. Недаром Д.К. Львов [42] сравнивает риск активизации дремлющих в настоящее время инфекций с потенциальной возможностью извержения вулкана.
Вместе с тем, по-видимому, есть какие-то общие причины, способствующие активизации инфекций, ранее встречавшихся среди населения, но не приобретавших масштабов эпидемий или тем более пандемий. Выявленные, например, мутации у возбудителя лихорадки Эбола, отличающие современные штаммы вируса и, по-видимому, приведшие к столь жестокой эпидемии в 2014 г. [43], тем не менее, не объясняют, чем эти мутации вызваны? Почему вирус преодолел межвидовой барьер? От предыдущих эпидемию 2014 г. отличает то, что передача вируса от крыланов к человеку, по-видимому, произошла один раз, после чего животные перестали быть причиной заражения, и болезнь передавалась уже между людьми. Поэтому необходимо понять какие произошли изменения в биоценозе, приведшие к такому исходу событий? Нельзя не согласиться с мнением В.М. Жданова, Д.К. Львова [44], что «... только знание эволюции и современной экологии возбудителя поможет в одних случаях предупредить ухудшение эпидемиологической обстановки, в других - отыскать слабые звенья в цепи круговорота возбудителя в природе и путем направленного изменения структуры экосистемы в сочетании с комплексом специфических профилактических мероприятий может ликвидировать условия, ведущие к заражению людей».
В этом плане интересные сведения приведены в исследованиях под руководством Нуно Фарии [45], по выявлению некоторой общности в происхождении пандемии ВИЧ-инфекции и эпидемии лихорадки Эбола, зародившихся, как известно, в Центральной Африке. В частности, к распространению ВИЧ-инфекции привели активная трудовая миграция в 20-40-х годах прошлого века в Бельгийском Конго, влияние фактора расцвета проституции В 60-х годах прошлого века, и, как ни странно, - ухудшение ситуации в связи с попыткой конголезских властей развивать профилактическую медицину и бороться против других заболеваний: прививки и уколы делали, не обращая внимания на состояние шприцев.
Кстати, причина первой вспышки лихорадки Эбола 1976 г., начавшейся в г. Ямбуку (Заир, ныне Демократическая Республика Конго) - тоже многократное использование игл для инъекций без стерилизации. Тем не менее при всей значимости указанных факторов, они, как мы полагаем, только способствовали распро- 188
странению и укоренению ВИЧ-инфекции и лихорадки Эбола на Африканском континенте. Чем обусловлена столь выраженная активизация лихорадки Эбола в 2014 г. или почему началось пандемическое распространение ВИЧ-инфекции в 80-х годах, доподлинно не известно. М.В. Супотницкий в своей книге «Микробы, токсины, эпидемии» указывает на возможную связь в распространении ВИЧ-инфекции с ликвидацией натуральной оспы на Африканском континенте и в глобальном масштабе - на всей планете, что способствовало освобождению экологической ниши для ВИЧ. В этом плане весьма детальная оценка влияния различных факторов на появление «новых» инфекций и их активизацию приведена в монографии В.В. Шкарина и О.В. Ковалишеной «Новые инфекции: систематика, проблемы, перспективы» [46].
Необходимо подчеркнуть, что в современный период на планете можно выделить два главных очага эпидемиологической напряженности: Африканский континент и Юго-Восточная Азия. Именно из этих территорий в последние 30 с лишним лет вышли и получили распространение такие наиболее эпидемиологически и социально значимые инфекции, как ВИЧ (80-е годы), атипичная пневмония (SARS) и птичий грипп (90 -е годы), эпидемия лихорадки Эбола и коронавируса ближневосточного респираторного синдрома начало 2000-х гг. Мы не исключаем, что столь последовательная активизация указанных инфекций - явления одного порядка и, возможно, обусловлены антропогенными преобразованиями в биогеоценозе, на которые мы уже указывали выше. Проведение сопряженных эпидемиологических исследований, направленных на изучение условий, способствующих циркуляции вирусов в этих регионах и их активизации, как мы полагаем, помогло бы выявить общие факторы, влияющие на этот процесс. Однако дизайн исследований и их оценка должны строиться на иных теоретических концепциях, нежели - концепция «эпидемиологического треугольника», наиболее принятая в западных странах [37].
Благодаря большому количеству прямых и обратных связей внутри биогеоценоза, последний представляет собой весьма динамичную, чутко реагирующую на любое внешнее воздействие экосистему. В биогеоценозе, в частности, постоянно происходят периодические изменения численности входящих в него популя-
189
ций, зависящие, как известно, от колебаний пищевых ресурсов. Важным фактором, регулирующим численность популяции, являются эпизоотии. Для антропонозов таким пищевым ресурсов служит только человеческая популяция. Но именно Африканский континент и Юго-Восточная Азия характеризуются чрезвычайно высокой численностью населения и тенденцией к ее увеличению [46], что позволяет сделать логический вывод: в этих условиях инфекции не утратили роли естественного отбора. Заметим, что известный советский паразитолог-эпидемиолог В.Н. Беклемишев еще в 1945 г. писал «Паразиты являются нормальными сочленами биоценозов и вызываемые ими болезни и даже эпидемии (эпизоотии) большей частью принадлежат к числу нормальных жизненных отправлений биоценоза, поддерживающих качественное и количественное постоянство его состава».
Суммируя все вышеприведенные данные, саморегуляцию антропоэкологической системы в биогеоценозе можно представить следующей схемой (рис. 8.5).
Главное в этой схеме - механизмы, обуславливающие саморегуляцию в отдельных паразитарных системах (инфекционноиммунологические) и между отдельными паразитарными системами (интеграционно-конкурентные). Вместе с тем регулируют и контролируют все происходящие в биогеоценозе самоперестройки - различные природные и социальные факторы. Природу одних мы знаем, других - нам только предстоит выяснить. Следует заметить, что антропоэкологическая система, как и биогеоценоз в целом, стремятся к определенной стабильности [16]. Перестройки, в частности, происходят в результате попадания в них естественным или искусственным путем представителей новых видов. Как всякая сложная многозвенная саморегулирующаяся система биогеоценоз отвечает на внешние воздействия как единое целое. Тем не менее для закрепления в них новых видов требуется, на наш взгляд, чтобы последние обладали определенным экологическим преимуществом перед другими видами, циркулирующими в популяции человека, ибо ресурсный потенциал ее не беспределен и требуется «экономное его расходование» [47, 48]. Образно говоря, «новые» виды должны получить «добро» на реализацию своего эпидемического потенциала от других микроорганизмов, сформировавших антропоэкологическую систему.
Поистине неисчерпаемым резервом для ее пополнения служит резервуар потенциальных патогенов среди животных и птиц. Вместе с тем и из антропо-экологической системы микроорганизмы могут уходить в популяцию животных, как это, по-видимому, вероятно при гриппе. Например, при кори наблюдалась эпизоотия этой инфекции среди горных горилл в Руанде в 1988 г. [46]. Возможные варианты обмена патогенами между популяциями животных и человека представлены в монографии В.В. Шкарина и
О.В. Ковалишеной [46].
Конечно механизмы саморегуляции в биогеоценозе, возможно, гораздо более многообразны и сложны, чем мы их себе представляем, но, тем не менее, концепция интеграционно-конкурентного развития ЭП, логически развивая идеи В.Д. Белякова, открывает новые перспективы в эпидемиологической оценке механизмов развития эпидемического процесса, а также формирования той или иной эпидемической ситуации, и соответственно, - в разработке противоэпидемических мероприятий.
При всей самодостаточности указанной теории, она, тем не менее, базировалась на традиционном постулате инфекционноиммунологических отношений между микробом и организмом человека. Однако всегда ли и при всех инфекциях иммунитет является регулирующим механизмом, препятствующим их распространению? При инфекциях наружных кожных покровов, желудочнокишечного тракта (за исключением энтеровирусных, в частности полиомиелита), кровяных (трансмиссивных) антропонозах тормозящее влияние популяционного иммунитета на развитие эпидемического процесса обычно не сказывается, поскольку число (относительное число) иммунных недостаточно для реального влияния на циркуляцию паразита [2]. Антитела как наиболее специфическая форма иммунного реагирования на инфекционные агенты часто не отражают состояние невосприимчивости (стерильного иммунитета), а являются лишь индикаторами иммунологической реактивности. По мнению А.А. Сохина [3], инфекционный иммунитет - не столько способ уничтожения и выведения, сколько один
173
из способов (сохранения) поддержания популяции возбудителя в организме биологического хозяина в форме, выгодной для обоих взаимодействующих видов. По-видимому, нестерильный иммунитет и связанное с ним бактерио- и вирусоносительство являются широко распространенной формой иммунитета к инфекционным заболеваниям в природе [4]. Сама реакция макроорганизма против патогенного микроба, так же как реакция микроба против хозяина по своей биологической сущности - взаимо приспособительная [5]. Поэтому инфекционная болезнь - это не борьба до победного конца, а своеобразный процесс приспособления, заканчивающийся чаще всего новой формой симбиоза организма и микроба. Сущность инфекционной болезни - это иммуногенез и выработка новых взаимоотношений эндосимбионта на новом, более высоком уровне защитных особенностей организма хозяина.
Необходимо подчеркнуть, что аргументация теории саморегуляции в основном базируется на микробиологических исследованиях и в ней весьма детально отражены все фазы развития микроорганизма как в отдельном организме в ходе развития инфекционного процесса, так и в популяции в целом - в ходе развития процесса эпидемического [6]. Целенаправленных иммунологических исследований в этом плане мы не встретили, а все возможные изменения степени восприимчивости популяции в связи с циркуляцией того или иного возбудителя априори базировались на существующих взглядах на иммунный ответ как в отдельном организме, так и в популяции человека в целом. При этом позднее сам В.Д. Беляков с соавт. [1] отмечали, что «...движение информации как в вертикальном, так и горизонтальном направлении за счет закрепления программ изменчивости, индуцированных реакций и переноса генов позволяет популяции микроорганизмов выступать как интегрированное целое, аналогичное гигантскому многоклеточному организму», т.е. популяция реагирует на различные влияния извне не формированием иммунитета, а «движением информации» [1]. Созвучно этому и мнение Е.И Болотина с соавт. [7], считающих, что «.антропонозные инфекции формируют антропоэкологические системы, центральным элементом которых выступает человек. Их размеры изменяются в широком диапазоне - от индивидуальной микросистемы, образуемой отдельным 174 человеком, до глобальной макросистемы, включающей все население Земли. При этом все сферы существования микроорганизмов имеют коммуникационные связи, в частности обеспечивающие движение между ними генетической информации».
Правомерность таких суждений подтверждают исследования ученых Массачусетского технологического института (США), показавших, что взаимодействие микроорганизмов можно сравнить со всемирной генетической сетью, внутри которой постоянно циркулирует важная генетическая информация. При этом генами обмениваются совершенно далекие друг от друга группы бактерий: некоторые из них, по данным исследователей, отличаются друг от друга, как дрожжевой грибок от человека. Возможные способы обмена генами между бактериями: с помощью вирусов, вне хромосомных плазмидных ДНК или просто через ДНК от мёртвой клетки [8]. Перенос генетического материала между отдаленно родственными видами микроорганизмов рассматривается как естественный процесс, обеспечивающий их адаптацию и выживание в меняющемся микро- и макромире.
Важно также подчеркнуть, что с позиций теории саморегуляции паразитарных систем В.Д. Беляковым объяснялась и природа цикличности инфекционных болезней. Однако формирование популяционного иммунитета как фактора влияющего на динамику инфекционных болезней, в большей мере характерно для инфекций с воздушно капельным путем передачи [2], тогда как цикличность как явление присуща практически всем инфекциям [9]. Однако и В.Д. Беляков с соавт. впоследствии пришли к следующему заключению «.. .не будет вульгаризацией считать, что микроорганизмы, живущие в человеческих коллективах, сами создали себе сезонные и циклические колебания инфицированности» [10].
Все вышеизложенное, по нашему мнению, свидетельствует о том, что к объяснению явления саморегуляции паразитарных систем следует подходить и с других позиций. В частности, теория саморегуляции не учитывала того обстоятельства, что филогенез возбудителей инфекционных болезней проходил в условиях тесного и избирательного взаимодействия отдельных видов. В орга-
175
низме хозяина и во внешней среде микроорганизмы сформировали различные биоценозы, постоянно подвергаясь в них влиянию абиотических и биотических факторов. Сложившиеся взаимоотношения между сочленами биоценоза могут быть и интеграционными (сотрудничество), и конкурентными, что, несомненно, сказывается и на проявлениях ЭП [11-14].
В этой связи среди биологов прежде всего зреет понимание того, что следует изучать не закономерности жизнедеятельности отдельных видов животных, растений или микроорганизмов, а необходимо проводить сопряженный анализ, направленный на оценку всех субъектов, формирующих биоценоз (биогеоценоз) [15, 16]. По-мнению И.И. Шмальгаузена [16], именно биоценоз выступает по отношению ко всем составляющим его популяциям видам как управляющее устройство. Его самонастройка составляет основу приспособленности видов к среде обитания и взаимного приспособления их друг к другу. Следовательно, к оценке саморегуляции, как мы полагаем, следует подходить не только изучая механизмы, способствующие саморегуляции в отдельной паразитарной системе, но и с позиций биоценотических, направленных на изучение механизмов, обусловливающих саморегуляцию всей антропоэкологической системы - т.е. «...единого пространственно-временного образования, способного занимать географическую территорию любого масштаба и включающую весь комплекс патогенов в человеческой популяции» [7]. При этом антропоэкологическую систему следует рассматривать как составную часть биогеоценоза, в который помимо этой системы входит мир животных, растений и других микроорганизмов, не затрагивающих человеческую популяцию.
Однако в эпидемиологии традиционно принято изолированно рассматривать ЭП любой инфекции. Существующие в настоящее время теории эпидемиологии не принимают во внимание возможность интеграционно-конкурентных взаимоотношений между микроорганизмами в антропоэкологической системе, а в эпидемиологических исследованиях, как правило, не дается оценка возможному отражению этих взаимоотношений на популяционном уровне. Между тем сопряженная эволюция паразитизма и патогенности постоянно переплеталась на всех уровнях развития 176 живой материи - от растений и даже микроорганизмов (болезни бактерий) до беспозвоночных (от простейших до членистоногих), позвоночных животных (рыб, земноводных, птиц и млекопитающих) а также вида Homo sapiens [12]. Постоянное взаимодействие потенциально патогенных для людей (животных) микроорганизмов с макроорганизмами сопровождается антагонистическими (конкуренция) и синергетическими (интеграция) отношениями между сочленами паразитарных систем из-за острой конкуренции среди паразитов за чувствительные организмы хозяев, а в последних - за чувствительные ткани [17]. По мнению А.А. Селиванова [18] конкурентные или интеграционные взаимоотношения между возбудителями могут возникать как при непосредственном взаимодействии, так и опосредовано: через иммунную систему хозяина или на межпопуляционном уровне. При этом бактерии и вирусы, видимо, способны влиять на вирулентность друг друга [19]. В подтверждение вышесказанному, при анализе литературных публикаций, нами было отмечено, что вирус гриппа А, взаимодействуя с возбудителем скарлатины и других стрептококковых инфекций - бета-гемолитическим стрептококком группы А (БГСА), или Streptococcus pyogenes, повышает вирулентность последнего [20]. К сожалению, методические подходы к изучению результатов взаимоотношений между микроорганизмами на популяционном уровне не разработаны. Как мы полагали, возможность и эпидемиологические последствия указанных взаимодействий легче проследить в закрытых коллективах, где ЭП относительно автономен, а спектр потенциальных патогенов беден. В частности, проводимые нами исследования в рамках морской эпидемиологии позволили установить, что при сочетанном выделении в ходе рейса от моряков вирусов гриппа А и БГСА или аденовирусов и БГСА, штаммы БГСА обладали более высокой гидрофобностью, косвенно свидетельствующей об их высокой вирулентности [21]. Следовательно, и вирусы гриппа А, и аденовирусы способны повышать вирулентность БГСА.
Общеизвестно, что вирусы «открывают дорогу» бактериям. Однако и бактерии способны влиять на развитие ЭП вирусной инфекции. Так БГСА обладает антиинтерфирирующим действием и влияет на выработку антител к респираторным вирусам [22].
177
Приведенные материалы результатов экспериментальных исследований указывали на вероятность интеграционно-конкурентных взаимоотношений между БГСА и респираторными вирусами (РВ). Принимая во внимание многоуровневый характер ЭП [23, 24], это явление, как мы полагаем, должно найти отражение в проявлениях ЭП инфекций, вызываемых данными возбудителями (грипп, ОРЗ, ангина, скарлатина), и, прежде всего, в динамике заболеваемости и ее уровне.
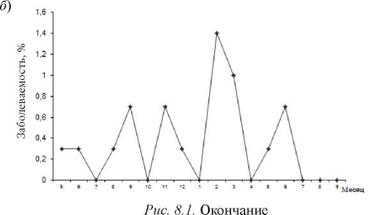
Эпидемиологическая оценка результатов сопряженного ретроспективного анализа динамики заболеваемости ОРЗ и ангиной моряков и рыбаков в ходе рейса на 11 судах (плавбазы, плавзаводы) со средней численностью экипажа 280-450 чел. за 1983-1991 гг. показала, что ЭП указанных нозоформ не совпадал по фазе своего развития. Для направленности их динамики заболеваемости была характерна обратная корреляционная связь средней силы (г = 0,4-0,6). Кроме того, значительное превышение среднерейсового уровня заболеваемости ОРЗ не сопровождалось подобными изменениями показателей для ангины (рис. 8.1). Аналогичные сведения, указывающие на последовательную цикличность проявлений ЭП этих заболеваний в коллективе, с учетом одновременной циркуляции РВ и БГСА в последующем мы нашли и у других исследователей [25].
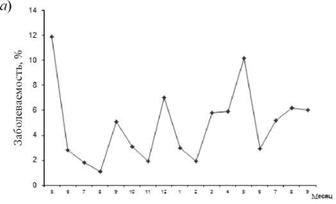
Рис. 8.1. Заболеваемость ОРЗ (а) и ангиной (б) на плавбазе «Североуральск» в рейсе 1989-1990 гг. |
 |
В ходе длительного промыслового рейса (около 7 мес. без захода в порты) на рыбомучной базе «Е. Лебедев» в 1991 г. нами проводились бактериологические, вирусологические и иммунологические исследования, направленные на изучение механизмов формирования заболеваемости респираторной стрептококковой инфекции у членов экипажа [26]. В результате исследований установлено, что ведущими факторами, способствующими активизации ЭП в ходе рейса, являются «выход в море и первый месяц плавания» и «3-4-й месяц пребывания в рейсе». Именно эти факторы риска приводят к формированию внутри рейсовых подъемов заболеваемости ОРЗ и ангиной в длительном плавании без захода судна в порты. Анализ динамики этих подъемов заболеваемости по пятидневкам рейса на судах разного типа позволил установить, что практически во всех случаях рост числа заболевших в первую пятидневку начинался с ОРЗ, предваряя последующий рост заболеваемости членов экипажа ангиной. Затем вновь нарастала заболеваемость ОРЗ с последующим ее прекращением или проявлением спорадическими случаями (рис. 8. 2).
Сопоставление приведенных выше материалов с соответствующими данными литературы [11], подтверждало наше предположение о возможности реализации интеграционно-конкурентных взаимоотношений между РВ и БГСА на локальном уровне развития ЭП.
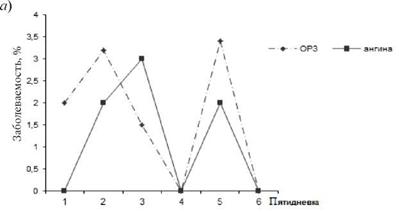 |
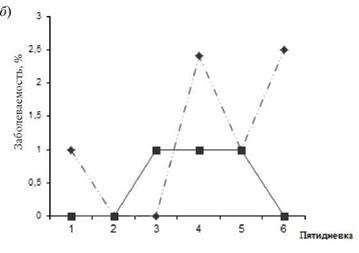
Рис. 8.2. Заболеваемость членов экипажа ОРЗ и ангиной под влиянием факторов «выход в море и первый месяц рейса» (а) и «3-4-й месяц рейса» (б) на РМБ «Е. Лебедев» в 1991 г. |
В свете представленных данных механизм развития ЭП указанных инфекций в рейсе можно интерпретировать следующим образом. В результате действия вышеназванных факторов риска у членов экипажа происходит изменение иммунного статуса, способствующее активизации, наиболее выражено проявляющей себя в закрытых коллективах аденовирусной инфекции [11], т.е. трансформации ее из состояния носительства в манифестную форму, что и проявляется возникновением случаев ОРЗ (см. гл. 4). Распространение аденовирусов в коллективе способствует повышению вирулентности циркулирующих здесь БГСА, создает предпосылки к становлению эпидемического варианта пиогенного стрептококка и развитию последующей фазы ЭП - эпидемическому распространению [1], приводя к заболеванию ангиной. Кроме того, ОРЗ интенсифицируют механизм передачи БГСА [27]. Постепенное ограничение циркуляции БГСА (соответственно снижение активности ЭП) обусловлено формированием типоспецифического к данному штамму стрептококка иммунитета. В то же время, как мы указывали выше, БГСА обладают антиинтерфирирующим действием и способны ингибировать выработку антител к РВ, поэтому они, в свою очередь, активизируют ЭП респираторных вирусов с последующим нарастанием ОРЗ. Впрочем, и их распространение так же ограничивает формирующийся у членов экипажа коллективный иммунитет. Поскольку известно, что развитие ЭП заканчивается при наличии определенного потенциала неиммунных лиц [1], то, как мы полагаем, наряду с формированием иммунитета к соответствующему РВ, определенное ограничивающее влияние на их распространение оказывают и БГСА. Последние, в этой ситуации, вступают уже в конкурентные взаимоотношения с РВ. Не исключено, что ограничивающее влияние БГСА на ЭП РВ связано с секреторными иммуноглобулинами слюны, которые, препятствуя адсорбции антигенов на слизистых, таким образом, ингибируют наиболее важную адгезивную стадию инфекционного процесса. Кроме того, секреторные иммуноглобулины способны нейтрализовать вирусы, которые находятся внутри эпителиальных клеток, в момент их перемещения с базальной к апикальной поверхности слизистых [28].
Следовательно, активизация эпидемического процесса и его угасание возможны не только вследствие реализации инфекционно-иммунологического механизмов, но и в результате воздействия паразитарной системы одной инфекции на паразитарную систему другой. В соответствии с представленной концепцией интеграционно-конкурентного развития ЭП, инфекции, имеющие общую локализацию и/или механизм передачи, могут влиять (активизировать или тормозить) на развитие ЭП друг друга. Как мы полагаем, благодаря интеграционно-конкурентным взаимоотношениям, становится возможным поддержание одновременной циркуляции и длительного сохранения различных паразитических видов в условиях ограниченных ресурсов обитания.
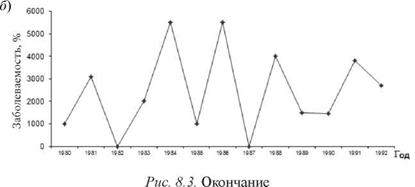
Выявленные нами на локальном уровне ЭП интеграционноконкурентные взаимоотношения РВ и БГСА, позволяют предполагать, что они могут проявиться и на региональном уровне. С этой целью мы сопоставили многолетнюю динамику заболеваемости скарлатиной и гриппом населения Владивостока. Выбор именно этих нозоформ обусловлен тем, что возникновение заболеваний скарлатиной свидетельствует о циркуляции среди населения наиболее вирулентных штаммов БГСА. Подъем заболеваемости гриппом отражает фазу эпидемического распространения этой инфекции [1]. Как показали результаты анализа, пики заболеваемости скарлатиной и эпидемических вспышек гриппа среди населения Владивостока носили разнонаправленный характер и не совпадали (рис. 8.3).
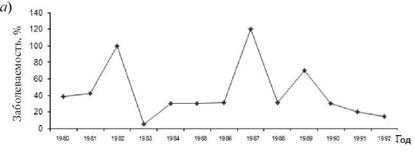
Рис. 8.3. Многолетняя динамика заболеваемости скарлатиной (а) и гриппом (б) населения Владивостока |
 |
Важно отметить, что и годовая динамика заболеваемости скарлатиной в период эпидемий гриппа и вне их существенно разнилась. При этом прежде всего изменялась интенсивность весеннего подъема скарлатины: в межэпидемический по гриппу период пик заболеваемости был значительно выше, чем в эпидемический (рис. 8.4).
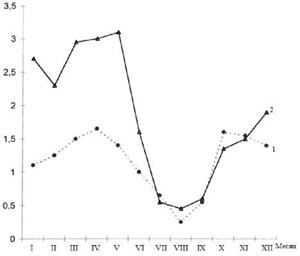
Рис. 8.4. Годовая динамика заболеваемости скарлатиной в эпидемический (1) и меж эпидемический (2) периоды заболеваемости гриппом во Владивостоке (по средним данным за 1980-1992 гг.) |
Следовательно, интеграционно-конкурентные взаимоотношения между РВ и БГСА проявляются и на региональном уровне развития ЭП. С эволюционных позиций эти результаты вполне объяснимы, ибо одновременная циркуляция среди населения (причем, преимущественно детского) высоковирулентных штаммов БГСА и гриппа способна оказать неблагоприятное влияние на его жизнедеятельность. Имеющиеся наблюдения свидетельствуют об усилении летального эффекта от стрептококковой инфекции, даже в случае инфицирования авирулентным вариантом, если этому предшествовало заболевание гриппом [20]. Следует заметить, что аналогичные результаты нами получены и при интеграционном подходе к изучению эпидемиологии гепатитов В и С, ВИЧ- инфекции и парентеральных гепатитов, дизентерии и гепатита А [29-31].
Выявленные интеграционно-конкурентные взаимоотношения в развитии ЭП вполне закономерны. Известно, что ни одна из его фаз не дает возбудителю возможность сохраняться как виду [1]. Их чередование, постоянная смена одного возбудителя другим позволяют адаптироваться, проявить патогенность и существовать каждому из них. В этой связи важно подчеркнуть, что исследователями давно замечено, что инфекции с одинаковым механизмом передачи и первичной специфической локализацией не совпадают по фазе своего развития [32]. По справедливому замечанию Г.П. Надарая [33], одному из первых применивших интеграционный подход к изучению ЭП различных инфекций, «.. .есть всеобщая согласованность закономерности совместного распространения инфекций, и она - атрибут их далекого эволюционного прошлого». Правомочность таких суждений подтверждают достижения микробиологии за последние десятилетия, которые показали, что бактерии для своего выживания, так же как и люди, широко используют преимущества, которое дает коллективное поведение [34]. Однако, если такое поведение доказано для бактериального сообщества, то оно вполне вероятно и для взаимоотношений между вирусами и бактериями, или вирусами и простейшими и т.п. Как мы полагаем, «договоренность» может реализовываться и через интеграционно-конкурентные механизмы взаимодействия. Все это «.обусловлено эволюционной мудростью природы, спо- 184 собствующей наиболее рациональному использованию иммунного потенциала населения с целью сохранения как непосредственного хозяина, так и паразита» [33].
Таким образом, представленные нами результаты исследований свидетельствуют о том, что саморегуляция присуща не только отдельно взятой паразитарной системе, но и антропоэкологической системе в целом. При этом основными механизмами саморегуляции наряду с инфекционно-иммунологическими будут и интеграционно - конкурентные взаимоотношения между видами, поскольку именно они обеспечивают стабильность существования любых систем [35]. Как мы полагаем, главным связующим звеном между различными антропопаразитарными системами в биогеоценозе являются вирусы. Во-первых, именно они влияют на вирулентность бактерий, способствуя их выходу из фазы резервации, и тем самым играют триггерную роль в развитии ЭП. Во-вторых, наряду с внехромосомными плазмидными ДНК, вирусы обеспечивают обмен генами между бактериями [8]. В этой связи нельзя не привести мнение К.Г. Уманского [36], считающего вирусы вездесущими и необходимыми звеньями биосферы, роль которых (в основном) сводится к участию в адаптационных процессах, причем не только к адаптации к условиям среды обитания, но и к взаимной адаптации различных организмов в среде обитания, а также в процессах репарации и регенерации и, наконец, в эволюции в целом.
Следует заметить, что в эпидемиологической литературе часто встречается понятие «экологическая сбалансированность» [37]. Считается, что каждая из инфекций имеет свою экологическую нишу и ее освобождение вследствие, например, проводимых противоэпидемических мероприятий, способно привести к занятию ее новыми, ранее не встречающимися, инфекциями. В этом плане в литературе по экологии [38] приводится следующий пример: «любое сообщество можно представить себе как «-мерное пространство, занимаемое экологическими нишами разных видов. При диффузной конкуренции каждый вид взаимодействует с множеством других, конкурируя с ними по разным факторам среды. Успех или неудача закрепления вида в сообществе в первую очередь зависят от отношения конкуренции и эксплуатации с другими
185
видами. Представьте себе ящик, заполненный надутыми воздушными шариками: каждый из них давит на все остальные. Если популяция какого-то вида (шарик) «проиграет», то есть не сможет себя воспроизводить (лопнет), эффект от ее исчезновения приведет к сдвигу равновесия между всеми остальными популяциями (перемещению остальных шариков)». Как мы полагаем, такая сбалансированность может быть реализована только вследствие интеграционно - конкурентного взаимодействия между отдельными видами микроорганизмов.
Таким образом, инфекционно-иммунологические и интеграционно-конкурентные взаимоотношения - два дополняющих друг друга механизма, обусловливающих саморегуляцию антропоэкологической системы в биогеоценозе. Тем не менее важную контролирующую и регулирующую роль в развитии ЭП, способствующую реализации указанных механизмов, играют природные и социальные факторы (см. гл. 3). Как показывают результаты наших исследований и данные других авторов, в большей степени их влияние проявляется на локальном и региональном уровнях ЭП, тогда как на глобальном решающее значение имеет фактор (или факторы), способствующий формированию цикличности (см. гл. 5 [39]).
Следует заметить, что при эпидемиологической оценке указанного проявления ЭП, как правило, рассматриваются причины и условия, приводящие к одновременному подъему заболеваемости, тогда как ее снижение, преимущественно, объясняется проведением противоэпидемических мероприятий, нивелирующих возможность реализации механизма передачи инфекта. Несомненно, на локальном, да и на региональном уровнях ЭП, указанный фактор играет значимую роль, что находит свое отражение, прежде всего, в формировании определенного ординара заболеваемости в регионе и особенностях ЭП. Однако в глобальном аспекте следует учитывать тот факт, что любая биологическая система, а к ней, несомненно, относится и паразитарная, в своем развитии тратит энергию, что, на наш взгляд, и приводит к переходу возбудителя в фазу резервации или в организме человека в виде носительства, или к формированию ¿-форм и некультивируемых форм бактерий, а также биопленок или, возможно, даже - к резервации в популяции животных (например, вируса гриппа), поскольку микроор- 186
ганизмы, видимо, хорошо «понимают», что «прекрасный способ разбазаривания энергии - делать больше копий самого себя» [40]. В конечном итоге именно это явление, как мы полагаем, проявляется снижением заболеваемости.
Все вышеуказанные преобразования микроорганизмов направлены на длительное сохранение возбудителя в покоящемся состоянии и соответственно на формирование межэпидемического периода. К сожалению, какие факторы способствуют в последующем выходу микроорганизма из состояния покоя к активизации, мы доподлинно не знаем и можем лишь предполагать (см. гл. 5). По мнению В.М. Шубика, наличие сложных взаимоотношений в системе паразит - хозяин и большого числа связей между каждым из членов этой экосистемы и остальными членами биогеоценоза крайне затрудняет предвидение реакций всей этой сложной многозвенной системы (биогеоценоза) на внешние и внутренние воздействия. Существенное влияние на эти системы оказывают в настоящее время массовые противоэпидемические мероприятия, в частности профилактические прививки, широкое применение антимикробных препаратов и т.п. Все это дает основание предполагать наличие некоторой неустойчивости в системах паразит-хозяин и особую их чувствительность к действию новых экологических факторов [41]. Поэтому чрезвычайно сложно прогнозировать активизацию тех или иных инфекций, угрожающих или потенциально способных угрожать населению планеты.
В частности, генеральный директор Всемирной организации здравоохранения Маргарит Чен в одном из своих выступлений отметила, что риск возникновения масштабной эпидемии лихорадки Эбола в 2014 г. был недооценен. Но располагаем ли мы сегодня какими-то либо объективными критериями, способными спрогнозировать такую возможность? К сожалению, нет. Имеющиеся в современный период различные прогностические модели не учитывают всей сложности взаимосвязей между микроорганизмами в биогеоценозе. Поэтому прогноз развития той или иной эпидемиологической ситуации так же сложен, как, например, прогноз возникновения землетрясений и прочих катаклизмов. Недаром Д.К. Львов [42] сравнивает риск активизации дремлющих в настоящее время инфекций с потенциальной возможностью извержения вулкана.
Вместе с тем, по-видимому, есть какие-то общие причины, способствующие активизации инфекций, ранее встречавшихся среди населения, но не приобретавших масштабов эпидемий или тем более пандемий. Выявленные, например, мутации у возбудителя лихорадки Эбола, отличающие современные штаммы вируса и, по-видимому, приведшие к столь жестокой эпидемии в 2014 г. [43], тем не менее, не объясняют, чем эти мутации вызваны? Почему вирус преодолел межвидовой барьер? От предыдущих эпидемию 2014 г. отличает то, что передача вируса от крыланов к человеку, по-видимому, произошла один раз, после чего животные перестали быть причиной заражения, и болезнь передавалась уже между людьми. Поэтому необходимо понять какие произошли изменения в биоценозе, приведшие к такому исходу событий? Нельзя не согласиться с мнением В.М. Жданова, Д.К. Львова [44], что «... только знание эволюции и современной экологии возбудителя поможет в одних случаях предупредить ухудшение эпидемиологической обстановки, в других - отыскать слабые звенья в цепи круговорота возбудителя в природе и путем направленного изменения структуры экосистемы в сочетании с комплексом специфических профилактических мероприятий может ликвидировать условия, ведущие к заражению людей».
В этом плане интересные сведения приведены в исследованиях под руководством Нуно Фарии [45], по выявлению некоторой общности в происхождении пандемии ВИЧ-инфекции и эпидемии лихорадки Эбола, зародившихся, как известно, в Центральной Африке. В частности, к распространению ВИЧ-инфекции привели активная трудовая миграция в 20-40-х годах прошлого века в Бельгийском Конго, влияние фактора расцвета проституции В 60-х годах прошлого века, и, как ни странно, - ухудшение ситуации в связи с попыткой конголезских властей развивать профилактическую медицину и бороться против других заболеваний: прививки и уколы делали, не обращая внимания на состояние шприцев.
Кстати, причина первой вспышки лихорадки Эбола 1976 г., начавшейся в г. Ямбуку (Заир, ныне Демократическая Республика Конго) - тоже многократное использование игл для инъекций без стерилизации. Тем не менее при всей значимости указанных факторов, они, как мы полагаем, только способствовали распро- 188
странению и укоренению ВИЧ-инфекции и лихорадки Эбола на Африканском континенте. Чем обусловлена столь выраженная активизация лихорадки Эбола в 2014 г. или почему началось пандемическое распространение ВИЧ-инфекции в 80-х годах, доподлинно не известно. М.В. Супотницкий в своей книге «Микробы, токсины, эпидемии» указывает на возможную связь в распространении ВИЧ-инфекции с ликвидацией натуральной оспы на Африканском континенте и в глобальном масштабе - на всей планете, что способствовало освобождению экологической ниши для ВИЧ. В этом плане весьма детальная оценка влияния различных факторов на появление «новых» инфекций и их активизацию приведена в монографии В.В. Шкарина и О.В. Ковалишеной «Новые инфекции: систематика, проблемы, перспективы» [46].
Необходимо подчеркнуть, что в современный период на планете можно выделить два главных очага эпидемиологической напряженности: Африканский континент и Юго-Восточная Азия. Именно из этих территорий в последние 30 с лишним лет вышли и получили распространение такие наиболее эпидемиологически и социально значимые инфекции, как ВИЧ (80-е годы), атипичная пневмония (SARS) и птичий грипп (90 -е годы), эпидемия лихорадки Эбола и коронавируса ближневосточного респираторного синдрома начало 2000-х гг. Мы не исключаем, что столь последовательная активизация указанных инфекций - явления одного порядка и, возможно, обусловлены антропогенными преобразованиями в биогеоценозе, на которые мы уже указывали выше. Проведение сопряженных эпидемиологических исследований, направленных на изучение условий, способствующих циркуляции вирусов в этих регионах и их активизации, как мы полагаем, помогло бы выявить общие факторы, влияющие на этот процесс. Однако дизайн исследований и их оценка должны строиться на иных теоретических концепциях, нежели - концепция «эпидемиологического треугольника», наиболее принятая в западных странах [37].
Благодаря большому количеству прямых и обратных связей внутри биогеоценоза, последний представляет собой весьма динамичную, чутко реагирующую на любое внешнее воздействие экосистему. В биогеоценозе, в частности, постоянно происходят периодические изменения численности входящих в него популя-
189
ций, зависящие, как известно, от колебаний пищевых ресурсов. Важным фактором, регулирующим численность популяции, являются эпизоотии. Для антропонозов таким пищевым ресурсов служит только человеческая популяция. Но именно Африканский континент и Юго-Восточная Азия характеризуются чрезвычайно высокой численностью населения и тенденцией к ее увеличению [46], что позволяет сделать логический вывод: в этих условиях инфекции не утратили роли естественного отбора. Заметим, что известный советский паразитолог-эпидемиолог В.Н. Беклемишев еще в 1945 г. писал «Паразиты являются нормальными сочленами биоценозов и вызываемые ими болезни и даже эпидемии (эпизоотии) большей частью принадлежат к числу нормальных жизненных отправлений биоценоза, поддерживающих качественное и количественное постоянство его состава».
Суммируя все вышеприведенные данные, саморегуляцию антропоэкологической системы в биогеоценозе можно представить следующей схемой (рис. 8.5).
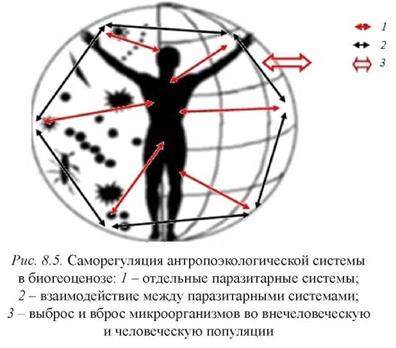 |
Главное в этой схеме - механизмы, обуславливающие саморегуляцию в отдельных паразитарных системах (инфекционноиммунологические) и между отдельными паразитарными системами (интеграционно-конкурентные). Вместе с тем регулируют и контролируют все происходящие в биогеоценозе самоперестройки - различные природные и социальные факторы. Природу одних мы знаем, других - нам только предстоит выяснить. Следует заметить, что антропоэкологическая система, как и биогеоценоз в целом, стремятся к определенной стабильности [16]. Перестройки, в частности, происходят в результате попадания в них естественным или искусственным путем представителей новых видов. Как всякая сложная многозвенная саморегулирующаяся система биогеоценоз отвечает на внешние воздействия как единое целое. Тем не менее для закрепления в них новых видов требуется, на наш взгляд, чтобы последние обладали определенным экологическим преимуществом перед другими видами, циркулирующими в популяции человека, ибо ресурсный потенциал ее не беспределен и требуется «экономное его расходование» [47, 48]. Образно говоря, «новые» виды должны получить «добро» на реализацию своего эпидемического потенциала от других микроорганизмов, сформировавших антропоэкологическую систему.
Поистине неисчерпаемым резервом для ее пополнения служит резервуар потенциальных патогенов среди животных и птиц. Вместе с тем и из антропо-экологической системы микроорганизмы могут уходить в популяцию животных, как это, по-видимому, вероятно при гриппе. Например, при кори наблюдалась эпизоотия этой инфекции среди горных горилл в Руанде в 1988 г. [46]. Возможные варианты обмена патогенами между популяциями животных и человека представлены в монографии В.В. Шкарина и
О.В. Ковалишеной [46].
Конечно механизмы саморегуляции в биогеоценозе, возможно, гораздо более многообразны и сложны, чем мы их себе представляем, но, тем не менее, концепция интеграционно-конкурентного развития ЭП, логически развивая идеи В.Д. Белякова, открывает новые перспективы в эпидемиологической оценке механизмов развития эпидемического процесса, а также формирования той или иной эпидемической ситуации, и соответственно, - в разработке противоэпидемических мероприятий.
Источник: А.А. Яковлев, Е.Д. Савилов, «ПРОБЛЕМНЫЕ ВОПРОСЫ ОБЩЕЙ ЭПИДЕМИОЛОГИИ» 2015
А так же в разделе «ГЛАВА 8 ЭВОЛЮЦИЯ ИДЕЙ АКАДЕМИКА В.Д. БЕЛЯКОВА О САМОРЕГУЛЯЦИИ ПАРАЗИТАРНЫХ СИСТЕМ В КОНЦЕПЦИИ ИНТЕГРАЦИОННО-КОНКУРЕНТНОГО РАЗВИТИЯ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА »
- ПРЕДИСЛОВИЕ
- ОТ АВТОРОВ
- ГЛАВА 1 ОБ ОПРЕДЕЛЕНИИ ЭПИДЕМИОЛОГИИ КАК НАУКИ И ПОНЯТИИ О ЕЕ ПРЕДМЕТЕ И ОБЪЕКТЕ
- Библиографический список
- ГЛАВА 2 СОВРЕМЕННЫЕ НАПРАВЛЕНИЯ В ЭПИДЕМИОЛОГИИ
- Эпидемиология хронических инфекций.
- Эпидемиология медленных инфекций.
- Эпидемиология сапронозов.
- Эпидемиология катастроф.
- Географическая (энвайроментальная) эпидемиология.
- Госпитальная эпидемиология.
- Эпидемиология неинфекционных болезней.
- 2.1. Молекулярная эпидемиология (на модели Mycobacterium tuberculosis)
- 2.1. Морская эпидемиология (история становления и основные направления развития)
- 2.1. Экологическая эпидемиология
- 2.4. Интеграционная эпидемиология
- Библиографический список
- ГЛАВА 3 О ПРИЧИНЕ, УСЛОВИЯХ И МЕХАНИЗМАХ ФОРМИРОВАНИЯ ЗАБОЛЕВАЕМОСТИ
- Классификация факторов риска эпидемического процесса
- Библиографический список
- ГЛАВА 4 О ВОЗМОЖНЫХ МЕХАНИЗМАХ РАЗВИТИЯ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
- Библиографический список
- ГЛАВА 5 О ВОЗМОЖНЫХ МЕХАНИЗМАХ ФОРМИРОВАНИЯ ЦИКЛИЧНОСТИ И СЕЗОННОСТИ В ЭПИДЕМИЧЕСКОМ ПРОЦЕССЕ
- Библиографический список
- ГЛАВА 6 ГЕТЕРОГЕННОСТЬ ПОПУЛЯЦИИ ВОЗБУДИТЕЛЯ И ХОЗЯИНА КАК ОСНОВА ТЕОРЕТИЧЕСКИХ ВОЗЗРЕНИЙ АКАДЕМИКА В.Д. БЕЛЯКОВА НА РАЗВИТИЕ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
- Библиографический список
- ГЛАВА 7 СИСТЕМНЫЙ ПОДХОД К ЭПИДЕМИОЛОГИЧЕСКОЙ ОЦЕНКЕ РОЛИ СОЧЕТАННЫХ ИНФЕКЦИЙ В РАЗВИТИИ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА (НА МОДЕЛИ ВИРУСНЫХ ГЕПАТИТОВ)
- Библиографический список
- Библиографический список
- ГЛАВА 9 ИНТЕГРАЦИОННЫЙ ПОДХОД К ЭПИДЕМИОЛОГИЧЕСКОЙ ОЦЕНКЕ НЕКОТОРЫХ НАПРАВЛЕНИЙ ПРОФИЛАКТИКИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
- Библиографический список
- ГЛАВА 10 ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ ЭПИДЕМИОЛОГИЧЕСКОЙ ОЦЕНКИ ПАНДЕМИИ ГРИППА А(H1N1)pdm09 2009-2010 гг.
- Библиографический список
- ГЛАВА 11 ГЛОБАЛЬНЫЙ ЭПИДЕМИОЛОГИЧЕСКИЙ НАДЗОР КАК ОТВЕТ НА ГЛОБАЛИЗАЦИЮ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
- Библиографический список
- ЗАКЛЮЧЕНИЕ
- Библиографический список