Течение рецидивирующей аритмии может быть весьма разнообразным. С одной стороны, эпизоды аритмии могут продолжаться несколько минут с выраженными симптомами, сменяясь многомесячными периодами синусового ритма. С другой стороны, длительные и бессимптомные периоды ФП могут сменяться кратковременными эпизодами синусового ритма.
Существует два основных метода лечения рецидивов ФП: восстановление и поддержание синусового ритма (rhythm control) и сохранение аритмии с контролем ЧСС (rate control).
По данным многих исследований (AFFIRM, PIAF, STAF, Hot Cafe; RACE) летальность не отличались при разных методах лечения. При контроле ритма выявлены лучшая переносимость физических нагрузок, более высокое качество жизни, тенденция к увеличению риска инсульта, в то время как при контроле ЧСС отмечена меньшая частота госпитализаций (Mead G.E., et al., 2005).
У пациентов с персистирующей ФП и артериальной гипертензией при контроле ЧСС сердечно-сосудистая заболеваемость и смертность были даже ниже, чем при фармакологическом поддержании синусового ритма (RACE). Данный феномен может быть обусловлен как аритмогенным эффектом медикаментов, так и повышенной частотой тромбоэмболий при сопутствующем повышении АД (Corley S.D., et al., 2004; Lip G.Y.H., et al., 2007).
Вопрос о выборе той или иной тактики ведения решается индивидуально. У пожилых пациентов с персистирующей ФП и заболеванием сердца в большинстве случаев разумнее контролировать ЧСС. У молодых пациентов с симптомами, несмотря на контроль ЧСС, и при ситуациях, когда потеря сокращения предсердий может существенно снизить сердечный выброс (выраженная диастолическая дисфункция левого желудочка), предпочтительнее выглядит поддержание синусового ритма. Оба подхода можно комбинировать при недостаточной эффективности контроля ритма.
Относительно низкая эффективность восстановления и поддержания синусового ритма отмечается при ситуациях, представленных в таблице 18. В этих случаях предпочтительнее контроль ЧСС. Недавно возникшая ФП (lt;48-72 ч) в 50-70% спонтанно прекращается.
Основным предиктором высокой частоты спонтанного восстановления синусового ритма является небольшая продолжительность аритмии. Поэтому есть смысл, при отсутствии выраженных гемодинамических нарушений, отложить восстановление ритма на следующий день, ограничившись контролем ЧСС.
Спонтанное купирование аритмий происходит реже, если имеются структурные изменения сердца: гипертоническое сердце, ИБС, сердечная недостаточность, диаметр левого предсердия gt;45 мм, ФВ левого желудочка lt;45%, выраженная митральная регургитация (Cotter G., et al., 1999).
Таблица 19
Относительные противопоказания к восстановлению синусового ритма Сохранение причины ФП
Митральный порок, требующий хирургического лечения, гипертиреоз,
хроническая обструктивная болезнь легких,
сердечная недостаточность IV ФК при непереносимости амиодарона. Низкая эффективность кардиоверсии Левое предсердие gt;60 мм (диаметр), длительность аритмии gt;1 года,
возраст gt;65 лет при пороках сердца и gt;75 лет при ИБС, неэффективность предшествующей кардиоверсии.
Высокий риск рецидива ФП Неэффективность профилактического лечения, непереносимость антиаритмиков, предстоящая операция на сердце (до 1 мес), недавняя (до 6 мес) операция на сердце.
Опасность брадикардии (асистолии)
Синдром слабости синусового узла,
АВ блокада 2-3 степени.
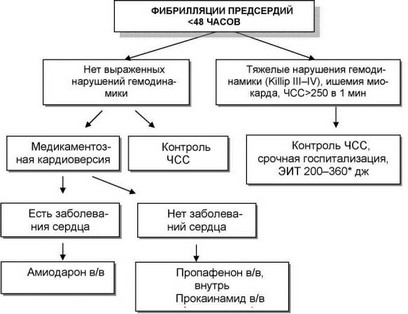
Рис. 38. Тактика лечения ФП (ESC, 2010). Примечание: * - монофазный
разряд, при бифазном разряде начинают со 100 дж.
Общая тактика ведения ФП, рекомендованная ведущими европейскими и американскими экспертами представлена на рисунке 38.
Временный контроль ЧСС
Быстрое снижение ЧСС с целью уменьшения симптомов применяется в первые сутки ФП, когда ожидают спонтанного прекращения аритмии или при вторичной ФП.
Таблица 20
Препараты для быстрого контроля ЧСС (Jung F., et al., 1998; ESC, 2010; ICSI, 2007)
ЧСС считается контролируемой, если в покое возбуждение желудочков происходит с частотой 60-80 в мин, а при умеренной физической нагрузке - с частотой 90-115 в мин.
Для этого назначают бета-блокаторы, антагонисты кальция и дигоксин (таблица 20), которые редко восстанавливают синусовый ритм. Следует помнить об опасности такого подхода, особенно при лечении дигоксином и верапамилом, при синдроме WPW с быстрым дополнительным путем проведения (высокая ЧСС, широкие комплексы, феномен WPW на ЭКГ с синусовым ритмом) - в этом случае назначают амиодарон.
Дигоксин применяется реже вследствие позднего начала действия (через 2 ч) и не всегда эффективного вагус-опосредованного контроля ЧСС.
Среди бета-блокаторов предпочитают эсмолол, поскольку у него очень короткое время начала и прекращения эффекта.
Удобны верапамил и дилтиазем, которые начинают действовать через 4-5 мин после внутривенного болюсного введения и их действие может поддерживаться при инфузии.
Восстановление синусового ритма
Во время ФП происходят морфологические и электрические изменения предсердий (ремоделирование), которые способствуют сохранению аритмии. Поэтому нужно стремиться восстановить синусовый ритм как можно раньше. Восстанавливают синусовый ритм с помощью фармакологических (пероральных или внутривенных) средств или электроимпульсной терапии (ЭИТ).
Каждая методика имеет свои преимущества и недостатки. Медикаментозная кардиоверсия наиболее эффективна до 2-7 суток от начала аритмии, позднее результаты лечения значительно хуже. ЭИТ - самый эффективный метод восстановления синусового ритма, но ее широкое применение сдерживается необходимостью анестезии.
Выбор метода кардиоверсии определяется тяжестью состояния, течением аритмии, безопасностью лечения и возможностями лечебного учреждения.
Предупреждение тромбоэмболий
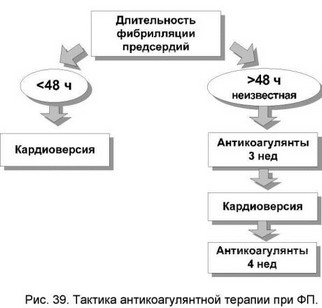
Тактика купирования ФП существенно зависит от длительности аритмии. При сохранении ФП gt;48 ч значительно повышается риск тромбоэмболий и поэтому требуется антикоагулянтная терапия (рисунок 38). Обычно назначают варфарин в дозе 5 мг/сут и подбирают дозу по МНО (2-3). До развертывания эффекта варфарина рекомендуют назначение инфузии гепарина.
По данным исследования АСЕ возможно вместо варфарина проводить длительную терапию эноксапарином, который позволяет сразу добиться гипокоагуляции и не требует контроля.
Пероральный ингибитор тромбина дабигатран (прадакса) предупреждает инсульты и тромбоэмболии также эффективно, как и варфарин (в дозе 150 мг 2 раз даже лучше), возможно с меньшим риском внутримозговых кровоизлияний (в дозе 110 мг 2 раза) и не требует контроля МНО (RE-LY, Nagarakanti R., et al., 2011). Дабигатран может использоваться как альтернатива варфарину при пароксизмальной и постоянной ФП с факторами риска тромбоэмболий у пациентов без искусственных клапанов сердца, гемодинамически значимых пороков клапанов сердца, выраженной почечной недостаточности (клиренс креатинина lt;15 мл/мин), тяжелых заболеваниях печени с нарушением свертывания крови (ACCF/AHA/HRS, 2011).
При лечении антикоагулянтами тромбоэмболии после кардиоверсии возникают в 0,5-0,8% случаев, а без лечения - в 4,6-5,3% случаев (Arnold A.Z., et al., 1992).
При чреспищеводной эхокардиографии тромбы в предсердиях видны в 98%, поэтому при ФП длительность gt;48 ч и отсутствии предсердных тромбов исследовалась ранняя кардиоверсия без предварительной 3недельной антикоагулянтной терапии (ACUTE I). В этом случае пациентам назначают либо внутривенную инфузию гепарина (добиваясь времени свертывания крови в 1,5-2,5 раза выше исходного), либо подкожно вводят низкомолекулярный гепарин (например, эноксапарин 1 мг/кг 2 раза) и проводят кардиоверсию. Данный подход имеет как позитивные стороны - снижение риска кровотечений и времени лечения, так и потенциально негативные - тенденция к повышению смертности (2,4% против 1%, p=0,06), возможно более высокий риск тромбоэмболий по данным мета-анализа ранних исследований ускоренной кардиоверсии,
дискомфорт от фиброгастродуоденоскопии и последующего исследования (Moreyra E., et al., 1995).
При чреспищеводной эхокардиографии после длительной антикоагулянтной терапии в 7,7% выявляются тромбы в левом предсердии, однако учет этих данных не повлиял на частоту тромбоэмболий после электрической кардиоверсии в исследовании LOCS.
В случае экстренной кардиоверсии при ФП длительностью gt;48 ч и гемодинамическими осложнениями (стенокардия, инфаркт миокарда, шок, отек легких) назначают инфузию гепарина и одновременно непрямые антикоагулянты с последующей отменой гепарина через 4-5 дней после развертывания эффекта непрямого антикоагулянта.
После электрической и, по-видимому, медикаментозной кардиоверсии развивается состояние «оглушенных» предсердий (atrial stunning) со снижением сократимости в области аппендиксов в течение 2-4 нед. В этот период возрастает риск тромбообразования, поэтому требуется терапия антикоагулянтами до 4 нед.
По-видимому, целесообразна антикоагулянтная терапия перед кардиоверсией у пациентов с длительностью аритмии до 48 ч, но с наличием факторов риска тромбоэмболий, например, ревматическими пороками сердца, феноменом спонтанного эхоконтрастирования предсердий (похожие на дым завихрения, обусловленные вероятно агрегацией эритроцитов), сердечной недостаточностью или тромбоэмболиями в анамнезе (ICSI, 2007). В остальных случаях назначают при первой возможности инфузию нефракционированного гепарина или подкожно низкомолекулярный гепарин (ACCP, 2008).
Медикаментозная кардиоверсия
Эффект антиаритмических препаратов значительно выше, если они назначаются раньше. Например, если препараты вводят до 48 ч от начала тахиаритмии, то синусовый ритм восстанавливается в 60-90% случаев, а после 48 ч - всего лишь в 15-30%. Заметим, что в период до 48 ч нередко происходит и спонтанное восстановление сердечного ритма.
Для восстановления синусового ритма можно использовать препараты 1А, 1С и 3 класса. В целом наибольший эффект выявлен у препаратов 1С класса (пропафенон, флекаинид), однако они рекомендованы при отсутствии структурного поражения сердца.
При наличии ИБС и дисфункции левого желудочка предпочитают амиодарон, хотя его эффект развивается позднее, или ибутилид.
Пероральное купирование. Устранение ФП пероральными антиаритмическими препаратами проще и удобнее, чем с помощью парентеральных форм или ЭИТ (таблица 21) Полагают, что при длительности тахиаритмии до 7 дней эффективнее препараты 1С класса, а при больших сроках предпочтительнее препараты 3 класса.
Если состояние пациентов стабильное, а безопасность и эффективность препаратов подтверждены в стационаре, то пациенты могут самостоятельно восстанавливать синусовый ритм в амбулаторных условиях с помощью пропафенона (метод «таблетка в кармане», pill-in-the-pocket). Эффективность препарата при недавно начавшейся ФП достигает 8094% в ближайшие 6 ч (Alboni P., et al., 2004). Учитывая риск трепетания предсердий с проведением 1:1 показан предварительный прием бета- блокатора или антагониста кальция, например 80 мг верапамила за 2030 мин.
Амиодарон при пероральном приеме в дозе 30 мг/кг однократно восстанавливал синусовый ритм в 52% через 8 часов и в 87% через сутки (Peuhkurinen K., et al., 2000).
Назначение хинидина в больших дозах требует стационарных условий, вследствие риска синдрома удлиненного интервала QT. Поэтому во время лечения хинидином нужно контролировать интервал QT и быть готовым купировать магнезией двунаправленно-веретенообразную желудочковую тахикардию. Обычно контроль ЧСС достигается верапамилом с последующим назначением хинидина на 1-3 дня.
Таблица 21
Пероральные препараты для купирования ФП (Jung F., et al., 1998; ESC, 2010; ICSI, 2007)
Хотя предпочтительнее купировать ФП как можно раньше, некоторым пациентам может быть применен медленный метод восстановления синусового ритма (метод «жди-и-смотри») с помощью перорального приема амиодарона. Если через 1-2 месяца нет эффекта препарата, можно провести электрическую кардиоверсию.
Парентеральное купирование. Наиболее эффективны для восстановления синусового ритма препараты 1С и 3 класса (таблица 22). Вместе с тем препараты 1А и 1С класса могут вызвать выраженную тахикардию (часто ширококомплексную), связанную с появлением медленного трепетания с АВ проведением 1:1. Для предупреждения такой ситуации рекомендуют предварительно ввести антагонисты кальция (5-10 мг верапамила), бета-блокаторы (пропранолол 0,1 мг/кг) или дигоксин (0,75-1 мг). Пропафенон снижает АВ проведение намного слабее, чем бета-блокаторы и этого эффекта часто бывает недостаточно.
Некоторые специалисты после введения основной дозы антиаритмического препарата для повышения эффективности кардиоверсии и профилактики ранних рецидивов ФП рекомендуют продолжать низкодозовую инфузию, например, прокаинамид 2 мг/мин или пропафенон 0,5 мг/мин до 2 ч.
Антиаритмический эффект амиодарона в первые 2-6 ч не отличается от плацебо, но через 24 ч частота восстановления синусового ритма сопоставима с препаратами 1С класса (Chevalier P., et al., 2003). Более эффективно внутривенное введение препарата с последующей инфузией (Khan I.A., et al., 2003). Амиодарон может снизить АД, но не влияет на сократимость миокарда и внутрижелудочковую проводимость. При наличии структурного поражения сердца и факторов, снижающих вероятность купирования аритмии, возможно введение высоких доз амиодарона - 125 мг/ч в течение 24 ч (Cotter G., et al., 1999).
Отечественный препарат нибентан обладает высокой антиаритмической активностью при ФП, однако может вызывать значительное удлинение интервала QTc и двунаправлено-веретенообразную желудочковую тахикардию.
Для восстановления синусового ритма широко применяется электрическая кардиоверсия, эффективность которой значительно выше (7090%), чем медикаментов.
Таблица 22
Парентеральные препараты для купирования ФП (Jung F., et al., 1998; ESC, 2010; ICSI, 2007; ACCF/AHA/HRS, 2011)
Электрическая кардиоверсия
Чаще всего используют трансторакальную кардиоверсию, эффективность которой повышается с увеличением разряда, но возрастает риск повреждения миокарда. Существует неверное представление, что ФП можно эффективно купировать разрядом низкой величины. Предсердия располагаются относительно глубоко в грудной клетке, поэтому низкий разряд бывает часто недостаточен. При стойкой ФП эффективность монофазных разрядов в 100, 200 и 360 дж составила 14%, 39% и 95% соответственно, поэтому рекомендуют начинать с разряда 200 дж, а в случае отсутствия эффекта с интервалом не менее 3 мин (для уменьшения повреждения миокарда) дают разряды в 300 и 360 дж (Joglar J.A., et al., 2000; Kowley P.R., et al., 1998). Если разряд в 360 дж был неэффективен, то нередко помогает изменение позиции электродов или сочетание со сдавлением грудной клетки. По-видимому, наиболее эффективно передне-заднее расположение электродов (Ewy G.A., 1994; Kirchhof P., et al., 2002).
Бифазный дефибриллятор позволяет снизить мощность разряда, повреждение кожи и мышц, и увеличить эффективность кардиоверсии (Gall
N.P., Murgatroyd F.D., 2007). Применяется более низкая стартовая мощность бифазного разряда - 100, 150, 200 и 360 дж.
При длительной Фп (более 30 сут) целесообразно начинать электрическую кардиоверсию с больших разрядов - 300-360 дж монофазного и 200-360 дж бифазного.
Интервал между двумя последовательными разрядами не должен быть менее 1 мин.
Гибридная кардиоверсия
При популярном гибридном методе восстановления синусового ритма вначале назначают антиаритмические препараты, а затем при неэффективности последних проводят ЭИТ. В этом случае увеличивается эффективность ЭИТ и снижается риск рецидива тахиаритмии.
Показан эффект хинидина, прокаинамида, пропафенона, амиодарона, ибутилида и дофетилида. В частности, ибутилид повышает вероятность восстановления синусового ритма на 30% и снижет мощность эффективного разряда (Oral H., et al., 1999).
В то же время медикаментозное лечение может повысить порог дефибрилляции (флекаинид), увеличить ЧСС (1А и 1С класс без предварительной АВ блокады), вызвать желудочковую тахиаритмию или тяжелую брадикардию при наличии дисфункции синусового узла.
Профилактика рецидивов
Если причину тахиаритмии не удается устранить, то без лечения ФП рецидивирует в течение года в 80% случаев. Факторами риска рецидива аритмии считают следующие (Van Gelder I.C., et al., 1996):
По-видимому, ИАПФ и БРА снижают риск появления и рецидивов ФП, особенно у пациентов с сердечной недостаточностью (Anand K., et al., 2006; Schneider M.P., et al., 2010).
Существуют противоречивые данные о профилактическом антиаритмическом эффекте статинов (GISSI-HF, 2009; SPARCL, 2011; Rahimi K., et al., 2011) и омега-3-полиненасыщенных жирных кислот (Kowey P.R., et al., 2010; Jarett D.B., et al., 2010; Nodari S., et al., 2011).
Противотромботическая терапия. В контролируемых исследованиях отмечено повышение частоты тромбоэмболий при рецидивирующей ФП, сравнимое с частотой тромбоэмболий при постоянной форме (например, 3,2% против 3,3% в исследовании SPAF). Рецидивирующая ФП нередко не выявляется при обычных медицинских осмотрах. В то же время по данным Фремингемского исследования у 54% пациентов с инсультом без анамнеза ФП выявлена рецидивирующая форма тахиаритмии (Lin H.J., et al., 1995).
В исследовании AFFIRM было показано что даже при профилактической антиаритмической терапии частота инсультов не отличалась достоверно от группы пациентов с контролем ЧСС. Причем большинство инсультов развилось после прекращения приема варфарина или при недостаточном антикоагуляционном эффекте.
Таким образом, и при рецидивирующей форме, особенно с факторами высокого риска, показана антикоагулянтная терапия.
Медикаментозная профилактика рецидивов
Существует два основных подхода при рецидивирующей ФП с использованием антиаритмических препаратов: постоянный профилактический прием антиаритмиков и периодическое восстановление синусового ритма без профилактического лечения.
При первом эпизоде ФП профилактическое лечение обычно не проводят, поскольку следующий эпизод аритмии может развиться через несколько месяцев и даже лет. Антиаритмическая терапия также не целесообразна в случае нечастой и хорошо переносимой пароксизмальной ФП.
Ставить целью профилактического лечения полное устранение рецидивов аритмии нереалистично. Рецидивы аритмии возникают в среднем в 50% случаев, несмотря на лечение, соответствующее современным рекомендациям. Более разумно стремиться к снижению частоты приступов, их длительности и выраженности симптомов.
В таблице 23 представлены препараты, использующиеся для профилактики ФП. По данным плацебо-контролируемых исследований большинство антиаритмических препаратов имеют близкую эффективность. Поэтому выбор препарата определятся в основном наличием структурного поражения сердца и сопутствующей патологией.
Таблица 23
Препараты для профилактики ФП (ESC, 2010; ВНОК/ВНОА, 2010; ACCF/AHA/HRS, 2011)
Вместе с тем, заслуживают внимания результаты сравнительных испытаний препаратов, где было показано превосходство амиодарона перед препаратами 1 класса и соталолом. Например, в исследовании AFFIRM синусовый ритм сохранялся в течение года при лечении амиода- роном у 62%, препаратами 1 класса - у 23%, а соталолом - 38% пациентов. В исследовании SAFE-T среднее время рецидива ФП после восстановления синусового ритма при лечении амиодароном было в 4
По данным недавно закончившегося исследования дронедарон - препарат структурно сходный с амиодароном без йода - в 2-2,5 раза удлинял продолжительность синусового ритма по сравнению с плацебо (Singh
Если монотерапия неэффективна, то возможно подобрать комбинацию антиаритмических препаратов. Есть опыт сочетания бета-блокаторов, амиодарона или соталола с препаратами 1С класса (ACC/AHA/ESC, 2011). По данным исследования VEPARAF добавление верапамила к амиодарону или пропафенону снижало риск рецидива ФП после успешной кардиоверсии с 35 до 20% в течение ближайших 3 мес (De Simone A., et al., 2003).
Отсутствие структурного поражения сердца позволяет проводить лечение в амбулаторных условиях.
Хорошим эффектом обладают препараты 1С класса (пропафенон, флекаинид). Применяют также и соталол, наиболее оптимальный режим назначения которого, по-видимому, составляет 120 мг 2 раза в сут (Benditt D.J., et al., 1999). Лечение соталолом возможно если исходный интервал QTc не превышает 460 мсек, а в процессе лечения - 520 мсек (ACC/AHA/ESC, 2011).
Некогда очень популярный хинидин используется редко. Сдержанное отношение к этому препарату появилось после мета-анализа исследований длительного лечения хинидином, который выявил повышение летальности до 2,9% по сравнению с 0,9% в контрольной группе (Coplen S.E., et al., 1990). Однако более поздние сравнительные исследования этот вывод не подтвердили (Southworth M.R., et al., 1999; SOCESP).
В исследовании CTAF у 65% пациентов, получавших амиодарон (10 мг/кг/сут 2 нед, 300 мг/сут 4 нед и затем 200 мг/сут), в течение 16 мес рецидивов аритмии не было, а при лечении пропафеноном или соталолом синусовый ритм сохранялся лишь у 37% пациентов.
Вместе с тем, лечение амиодароном требует контроля функции щитовидной железы и трансаминаз (каждые 6 мес), а также рентгенографии грудной клетки (ежегодно). Недостатком препарата является очень медленное выведение из организма (до нескольких месяцев). Риск желудочковой тахиаритмии при удлинении интервала QT во время лечения амиодароном считается низким (lt;1%), поэтому электрокардиографический контроль рекомендуют не проводить, хотя описанный нами случай в разделе желудочковых тахикардий настораживает (ACC/AHA/ESC, 2011).
Структурное поражение сердца. Риск проаритмического действия препаратов повышается при структурном поражении сердца. Особенно часто осложнения развиваются в первые дни лечения, поэтому препарат лучше назначить в условиях стационара. Лечение проводят в стационаре до достижения насыщения (5 периодов полужизни препарата). Исключение составляет амиодарон с насыщающей дозой около 10 г. Какова оптимальная длительность лечения амиодароном в стационаре неясно, - обычно наблюдают в течение 4-5 дней.
В случае поражения сердца выбор препарата определяется сопутствующей патологией. При ИБС рекомендуют лечение соталолом, обладающим бета-блокирующим и антиангинальным эффектом. По данным мета-анализов рандомизированных исследований у пациентов после инфаркта миокарда амиодарон умеренно снижал общую летальность (на 13-29%), а препараты 1 класса повышали ее (ATMAI; Teo K.K., et al., 1993). Вместе с тем, у пожилых пациентов с ФП, перенесших инфаркт миокарда и принимающих амиодарон, более чем в 2 раза увеличилась частота имплантации ЭКС вследствие тяжелых брадикардий (Essebag V., et al., 2003).
ФП развивается в 40% случаев сердечной недостаточности, при которой особенно важно восстановление и поддержание синусового ритма, поскольку ФП снижает сердечный выброс на 10-20% независимо от частоты желудочкового ритма. Предпочтение отдают амиодарону, поскольку по данным мета-анализа крупных рандомизированных исследований (EPASMA, GESICA, CHF-STAT) у пациентов с сердечной недостаточностью показано снижение летальности (ACC/AHA/eSc, 2011). Заслуживает внимания и дофетилид, при лечении которым синусовый ритм восстановился у 59% пациентов и у 79% из них сохранялся в течение 1 года (DIAMOND). Важно отметить, что этот препарат не влиял на летальность после инфаркта миокарда и не усиливал дисфункцию левого желудочка.
Препараты 1 класса, особенно хинидин, могут повысить летальность при дисфункции левого желудочка согласно ретроспективному анализу исследования SPAF I. Кроме того, большинство препаратов 1А и 1С класса снижают сократимость миокарда.
При гипертоническом сердце возрастает риск ранней постдеполяризации, способной привести к возникновению двунаправленно
веретенообразной желудочковой тахикардии. Вследствие опасности лекарственных препаратов, удлиняющих интервал QT (1А, 3 класс), предпочтение отдают препаратам 1С класса, которые меньше влияют на интервал QT и не вызывают опасной желудочковой тахикардии (Prystowsky E.N., Katz A., 1997; Waldo A.L., Prystowsky E.N., 1998). В случае выраженной гипертрофии левого желудочка для снижения риска внезапной аритмической смерти предпочтительнее выглядит амиодарон.
Немедикаментозная профилактика рецидивов
Катетерная аблация. В последние годы широко применяют катетерную абляцию, которая позволяет изолировать источник аритмии в легочных венах и создать неблагоприятные условия для распространения патологических импульсов. Для определения места абляции обычно используют систему CARTO, которая позволяет на основе анализа внутриполостных электрических сигналов создать трехмерную геометрическую реконструкцию камеры сердца.
Обычно используют радиочастотное воздействие с формированием ожогового повреждения миокарда. Новая система криоабляции легочных вен (Freezor Cardiac CryoAblation Catheter) показала высокую эффективность при лечении пароксизмальной ФП, устойчивой к медикамента, и лишена традиционных осложнений радиочкстотной катетерной абляции.
Среди разработанных методик инвазивного катетерного лечения чаще используют круговую изоляцию легочных вен в левом предсердии, а также сегментарную изоляцию устьев легочных вен, фрагментацию задней стенки предсердия (HRS/EHRA/ECAS, 2007). В Научноисследовательском институте патологии кровообращения им.
Е.Н.Мешалкина развивают методику абляции ганглионарных сплетений в предсердиях, которая может быть эффективна при пароксизмальной ФП (Шабанов В.В., и соавт., 2010).
В случае сочетания ФП c типичным или индуцируемым истмус- зависимым трепетанием предсердий проводится также абляция кавотри- куспидального перешейка.
Кроме показаний, описанных в таблице 24, планируя лечение следует учитывать снижение эффективности процедуры при значительном увеличении левого предсердия, выраженном снижении функции левого желудочка, длительной персистирующей ФП, тяжелых заболеваниях легких, а также повышенный риск тромбоэмболий и перфорации миокарда у пожилых пациентов (ACCF/AHA/HRS, 2011; таблица 25).
Исходы аблации достоверно лучше в случае восстановления синусового ритма до 7 сут с помощью медикаментозной или электрической кар- диовресии, по сравнению с пациентами, у которых ФП сохранялась от недели до года перед инвазивным лечением (Winkle R.A., et al., 2011). В этой связи авторы рекомендуют прекратить аритмию как можно раньше перед проведением аблации.
Лечение бессимтомных ФП с помощью абляции считается нецелесообразным.
В целом абляция при ФП более опасна для пациента, чем абляция при других аритмиях, что связано с большей областью повреждения ткани, повышенной суммарной энергией, риском системной тромбоэмболии и близким расположением диафрагмального нерва, легочных вен и пищевода.
Применение 3-дневного курса кортикостероидов (гидрокортизон 2 мг/кг в день процедуры и 0,5 мг/кг преднизолона внутрь в течение 3 сут) снижает риск ФП в ближайшие дни и вплоть до 14 мес (Koyama T., et al., 2010).
Однократная абляция позволяет добиться устойчивого синусового ритма при пароксизмальной ФП в 38-78%, при персистирующей ФП - в 22-45% случаев, и показала высокую эффективность. Например, в исследовании F.Ouyang и соавт. (2010), изоляция легочных вен у пациентов с пароксизмальной ФП и нормальной функцией левого желудочка привела к сохранению синусового ритма после вмешательства в 80% случаев, а через 5 лет - в 46% случаев. Восстановление утраченной изоляции легочных вен после второй и третьей процедуры было эффективным в 94 и 67% случаев. В другом исследовании через 1, 2 и 5 лет после катетерной абляции синусовый ритм сохранялся в 40, 37 и 29% случаев с максимальной частотой рецидивов в первые 6 мес (Weerasooriya R., et al., 2011).
Таблица 24
Показания для немедикаментозного лечения ФП (HRS/EHRA/ECAS, 2007)
Катетерная абляция
Хирургическая абляция ФП
Таблица 25
Показания для катетерной аблации ФП (ACC/AHA/ESC, 2011)
11а класс (больше данных в пользу эффективности)
Катетерная абляция - возможная альтернатива фармакологическому лечения для предупреждения рецидивов ФП у симптомных пациентов с нормальными или немного увеличенными размерами левого предсердия.
Исследования свидетельствуют о большей эффективности абляции по сравнению с медикаментозным лечением. Например, по данным исследования STOP AF пациентов с пароксизмальной ФП после криоаблации в течение года синусовый ритм сохранялся у 70%, против 7,3% на медикаментах (O'Riordan M., 2010). В случае неэффективности хотя бы одного антиаритмического препарата радиочастотная аблация была эффективна через 9 мес у 66% пациентов против 16% на медикаментах (Wilber D.J., et al., 2010).
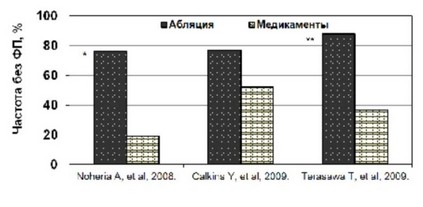
Рис. 40. Эффективность аблации у пациентов с ФП через год по даннным мета-анализов.
По данным мета-анализов (рисунок 39) аблация была эффективнее медикаментозного лечения для контроля синусового ритма в течение года (Noheria A., et al., 2008; Calkins Y., et al., 2009; Terasawa T., et al., 2009). Наибольший эффект приносит аблация, если применяется после безуспешной антиаритмической терапии у пациентов до 60 лет, с сохраненной функцией сердца и немного увеличенным левым предсердием (в среднем 50 мм).
В то же время исследования, сравнивающие абляцию и медикаменты, имеют существенные ограничения, часть которых планируется преодолеть в текущем исследовании CABANA (AHA, 2011).
Важно знать, что годовая смертность и качество жизни после абляции и на медикаментозном лечении достоверно не отличались (Dagres N., et al., 2009).
Таблица 26
Противопоказания для немедикаментозного лечения ФП
Среди осложнений абляции возможны тромбоэмболии (0-7%), инсульты (1-5%), тампонада сердца (1,2-6%), стеноз легочных вен (1,3-3,4%), повреждение пищевода (lt;0,3%), повреждение диафрагмального нерва (0-0,5%), ритмичные предсердные тахикардии (5-25%, обычно прекращающиеся через 3-6 мес), бедренная псевдоаневризма или артериовенозная фистула (0,4-0,5%). Применение катетеров с ирригационной системой на фоне лечения варфарином значительно снижает риск инсультов (Di Biase L., et al., 2010). Летальность процедуры составляет 1 случай на 1000 пациентов (Cappato R., et al., 2009).
При абляции в настоящее время применяют 3-мерные системы электрофизиологического картирования (CARTO, NavX), которые позволяют манипулировать катетерами бе
Существует два основных метода лечения рецидивов ФП: восстановление и поддержание синусового ритма (rhythm control) и сохранение аритмии с контролем ЧСС (rate control).
По данным многих исследований (AFFIRM, PIAF, STAF, Hot Cafe; RACE) летальность не отличались при разных методах лечения. При контроле ритма выявлены лучшая переносимость физических нагрузок, более высокое качество жизни, тенденция к увеличению риска инсульта, в то время как при контроле ЧСС отмечена меньшая частота госпитализаций (Mead G.E., et al., 2005).
У пациентов с персистирующей ФП и артериальной гипертензией при контроле ЧСС сердечно-сосудистая заболеваемость и смертность были даже ниже, чем при фармакологическом поддержании синусового ритма (RACE). Данный феномен может быть обусловлен как аритмогенным эффектом медикаментов, так и повышенной частотой тромбоэмболий при сопутствующем повышении АД (Corley S.D., et al., 2004; Lip G.Y.H., et al., 2007).
Вопрос о выборе той или иной тактики ведения решается индивидуально. У пожилых пациентов с персистирующей ФП и заболеванием сердца в большинстве случаев разумнее контролировать ЧСС. У молодых пациентов с симптомами, несмотря на контроль ЧСС, и при ситуациях, когда потеря сокращения предсердий может существенно снизить сердечный выброс (выраженная диастолическая дисфункция левого желудочка), предпочтительнее выглядит поддержание синусового ритма. Оба подхода можно комбинировать при недостаточной эффективности контроля ритма.
Относительно низкая эффективность восстановления и поддержания синусового ритма отмечается при ситуациях, представленных в таблице 18. В этих случаях предпочтительнее контроль ЧСС. Недавно возникшая ФП (lt;48-72 ч) в 50-70% спонтанно прекращается.
Основным предиктором высокой частоты спонтанного восстановления синусового ритма является небольшая продолжительность аритмии. Поэтому есть смысл, при отсутствии выраженных гемодинамических нарушений, отложить восстановление ритма на следующий день, ограничившись контролем ЧСС.
Спонтанное купирование аритмий происходит реже, если имеются структурные изменения сердца: гипертоническое сердце, ИБС, сердечная недостаточность, диаметр левого предсердия gt;45 мм, ФВ левого желудочка lt;45%, выраженная митральная регургитация (Cotter G., et al., 1999).
Таблица 19
Относительные противопоказания к восстановлению синусового ритма Сохранение причины ФП
Митральный порок, требующий хирургического лечения, гипертиреоз,
хроническая обструктивная болезнь легких,
сердечная недостаточность IV ФК при непереносимости амиодарона. Низкая эффективность кардиоверсии Левое предсердие gt;60 мм (диаметр), длительность аритмии gt;1 года,
возраст gt;65 лет при пороках сердца и gt;75 лет при ИБС, неэффективность предшествующей кардиоверсии.
Высокий риск рецидива ФП Неэффективность профилактического лечения, непереносимость антиаритмиков, предстоящая операция на сердце (до 1 мес), недавняя (до 6 мес) операция на сердце.
Опасность брадикардии (асистолии)
Синдром слабости синусового узла,
АВ блокада 2-3 степени.

Рис. 38. Тактика лечения ФП (ESC, 2010). Примечание: * - монофазный
разряд, при бифазном разряде начинают со 100 дж.
Общая тактика ведения ФП, рекомендованная ведущими европейскими и американскими экспертами представлена на рисунке 38.
Временный контроль ЧСС
Быстрое снижение ЧСС с целью уменьшения симптомов применяется в первые сутки ФП, когда ожидают спонтанного прекращения аритмии или при вторичной ФП.
Таблица 20
Препараты для быстрого контроля ЧСС (Jung F., et al., 1998; ESC, 2010; ICSI, 2007)
|
Препарат |
Нагрузочная доза |
Начало действия |
Поддерживающая доза |
|
Пропранолол |
в/в: 1 мг |
5 мин |
внутрь: 10-40 мг/сут 3 раза |
|
Метопролол |
в/в: 2,5-5 мг за 2 мин, до 3 доз |
5 мин |
внутрь: 100-200 мг/сут |
|
Верапамил |
в/в: 5 мг за 2 мин мин, каждые 30 мин |
3-5 мин |
в/в: 5-10 мг через 30 мин внутрь: 120-360 мг/сут |
|
Дилтиазем |
в/в: 0,25 мг/кг за 2 мин |
2-7 мин |
в/в: 5-15 мг/ч внутрь: 120-360 мг/сут |
|
Дигоксин |
в/в: 0,5-1 мг |
gt;60 мин |
в/в, внутрь: 0,125-0,375 мг/сут |
|
Амиодарон |
5 мг/кг за час |
дни |
в/в: 50 мг/ч внутрь: 200 мг/сут |
ЧСС считается контролируемой, если в покое возбуждение желудочков происходит с частотой 60-80 в мин, а при умеренной физической нагрузке - с частотой 90-115 в мин.
Для этого назначают бета-блокаторы, антагонисты кальция и дигоксин (таблица 20), которые редко восстанавливают синусовый ритм. Следует помнить об опасности такого подхода, особенно при лечении дигоксином и верапамилом, при синдроме WPW с быстрым дополнительным путем проведения (высокая ЧСС, широкие комплексы, феномен WPW на ЭКГ с синусовым ритмом) - в этом случае назначают амиодарон.
Дигоксин применяется реже вследствие позднего начала действия (через 2 ч) и не всегда эффективного вагус-опосредованного контроля ЧСС.
Среди бета-блокаторов предпочитают эсмолол, поскольку у него очень короткое время начала и прекращения эффекта.
Удобны верапамил и дилтиазем, которые начинают действовать через 4-5 мин после внутривенного болюсного введения и их действие может поддерживаться при инфузии.
Восстановление синусового ритма
Во время ФП происходят морфологические и электрические изменения предсердий (ремоделирование), которые способствуют сохранению аритмии. Поэтому нужно стремиться восстановить синусовый ритм как можно раньше. Восстанавливают синусовый ритм с помощью фармакологических (пероральных или внутривенных) средств или электроимпульсной терапии (ЭИТ).
Каждая методика имеет свои преимущества и недостатки. Медикаментозная кардиоверсия наиболее эффективна до 2-7 суток от начала аритмии, позднее результаты лечения значительно хуже. ЭИТ - самый эффективный метод восстановления синусового ритма, но ее широкое применение сдерживается необходимостью анестезии.
Выбор метода кардиоверсии определяется тяжестью состояния, течением аритмии, безопасностью лечения и возможностями лечебного учреждения.
Предупреждение тромбоэмболий
Тактика купирования ФП существенно зависит от длительности аритмии. При сохранении ФП gt;48 ч значительно повышается риск тромбоэмболий и поэтому требуется антикоагулянтная терапия (рисунок 38). Обычно назначают варфарин в дозе 5 мг/сут и подбирают дозу по МНО (2-3). До развертывания эффекта варфарина рекомендуют назначение инфузии гепарина.
По данным исследования АСЕ возможно вместо варфарина проводить длительную терапию эноксапарином, который позволяет сразу добиться гипокоагуляции и не требует контроля.
Пероральный ингибитор тромбина дабигатран (прадакса) предупреждает инсульты и тромбоэмболии также эффективно, как и варфарин (в дозе 150 мг 2 раз даже лучше), возможно с меньшим риском внутримозговых кровоизлияний (в дозе 110 мг 2 раза) и не требует контроля МНО (RE-LY, Nagarakanti R., et al., 2011). Дабигатран может использоваться как альтернатива варфарину при пароксизмальной и постоянной ФП с факторами риска тромбоэмболий у пациентов без искусственных клапанов сердца, гемодинамически значимых пороков клапанов сердца, выраженной почечной недостаточности (клиренс креатинина lt;15 мл/мин), тяжелых заболеваниях печени с нарушением свертывания крови (ACCF/AHA/HRS, 2011).
При лечении антикоагулянтами тромбоэмболии после кардиоверсии возникают в 0,5-0,8% случаев, а без лечения - в 4,6-5,3% случаев (Arnold A.Z., et al., 1992).
При чреспищеводной эхокардиографии тромбы в предсердиях видны в 98%, поэтому при ФП длительность gt;48 ч и отсутствии предсердных тромбов исследовалась ранняя кардиоверсия без предварительной 3недельной антикоагулянтной терапии (ACUTE I). В этом случае пациентам назначают либо внутривенную инфузию гепарина (добиваясь времени свертывания крови в 1,5-2,5 раза выше исходного), либо подкожно вводят низкомолекулярный гепарин (например, эноксапарин 1 мг/кг 2 раза) и проводят кардиоверсию. Данный подход имеет как позитивные стороны - снижение риска кровотечений и времени лечения, так и потенциально негативные - тенденция к повышению смертности (2,4% против 1%, p=0,06), возможно более высокий риск тромбоэмболий по данным мета-анализа ранних исследований ускоренной кардиоверсии,
дискомфорт от фиброгастродуоденоскопии и последующего исследования (Moreyra E., et al., 1995).
При чреспищеводной эхокардиографии после длительной антикоагулянтной терапии в 7,7% выявляются тромбы в левом предсердии, однако учет этих данных не повлиял на частоту тромбоэмболий после электрической кардиоверсии в исследовании LOCS.
В случае экстренной кардиоверсии при ФП длительностью gt;48 ч и гемодинамическими осложнениями (стенокардия, инфаркт миокарда, шок, отек легких) назначают инфузию гепарина и одновременно непрямые антикоагулянты с последующей отменой гепарина через 4-5 дней после развертывания эффекта непрямого антикоагулянта.
После электрической и, по-видимому, медикаментозной кардиоверсии развивается состояние «оглушенных» предсердий (atrial stunning) со снижением сократимости в области аппендиксов в течение 2-4 нед. В этот период возрастает риск тромбообразования, поэтому требуется терапия антикоагулянтами до 4 нед.
По-видимому, целесообразна антикоагулянтная терапия перед кардиоверсией у пациентов с длительностью аритмии до 48 ч, но с наличием факторов риска тромбоэмболий, например, ревматическими пороками сердца, феноменом спонтанного эхоконтрастирования предсердий (похожие на дым завихрения, обусловленные вероятно агрегацией эритроцитов), сердечной недостаточностью или тромбоэмболиями в анамнезе (ICSI, 2007). В остальных случаях назначают при первой возможности инфузию нефракционированного гепарина или подкожно низкомолекулярный гепарин (ACCP, 2008).

Медикаментозная кардиоверсия
Эффект антиаритмических препаратов значительно выше, если они назначаются раньше. Например, если препараты вводят до 48 ч от начала тахиаритмии, то синусовый ритм восстанавливается в 60-90% случаев, а после 48 ч - всего лишь в 15-30%. Заметим, что в период до 48 ч нередко происходит и спонтанное восстановление сердечного ритма.
Для восстановления синусового ритма можно использовать препараты 1А, 1С и 3 класса. В целом наибольший эффект выявлен у препаратов 1С класса (пропафенон, флекаинид), однако они рекомендованы при отсутствии структурного поражения сердца.
При наличии ИБС и дисфункции левого желудочка предпочитают амиодарон, хотя его эффект развивается позднее, или ибутилид.
Пероральное купирование. Устранение ФП пероральными антиаритмическими препаратами проще и удобнее, чем с помощью парентеральных форм или ЭИТ (таблица 21) Полагают, что при длительности тахиаритмии до 7 дней эффективнее препараты 1С класса, а при больших сроках предпочтительнее препараты 3 класса.
Если состояние пациентов стабильное, а безопасность и эффективность препаратов подтверждены в стационаре, то пациенты могут самостоятельно восстанавливать синусовый ритм в амбулаторных условиях с помощью пропафенона (метод «таблетка в кармане», pill-in-the-pocket). Эффективность препарата при недавно начавшейся ФП достигает 8094% в ближайшие 6 ч (Alboni P., et al., 2004). Учитывая риск трепетания предсердий с проведением 1:1 показан предварительный прием бета- блокатора или антагониста кальция, например 80 мг верапамила за 2030 мин.
Амиодарон при пероральном приеме в дозе 30 мг/кг однократно восстанавливал синусовый ритм в 52% через 8 часов и в 87% через сутки (Peuhkurinen K., et al., 2000).
Назначение хинидина в больших дозах требует стационарных условий, вследствие риска синдрома удлиненного интервала QT. Поэтому во время лечения хинидином нужно контролировать интервал QT и быть готовым купировать магнезией двунаправленно-веретенообразную желудочковую тахикардию. Обычно контроль ЧСС достигается верапамилом с последующим назначением хинидина на 1-3 дня.
Таблица 21
Пероральные препараты для купирования ФП (Jung F., et al., 1998; ESC, 2010; ICSI, 2007)
|
Класс |
Препарат |
Схема |
Время кардиоверсии |
Эффект % |
|
1А |
Хинидина сульфат |
200 мг через 2-3 ч повторять 5-8 раз |
2-6 ч |
45-60 |
|
1С |
Пропафенон |
450-600 мг однократно |
2-8 ч |
50-85 |
|
3 |
Амиодарон |
Стационар: а) 1200-1800 мг/сут до дозы 10 г и далее 200400 мг/сут б) 30 мг/кг однократно |
до 1-2 мес 6-24 ч |
40-90 |
|
|
|
Амбулаторно: 600-800 мг/сут до дозы 10 г и далее 200400 мг/сут |
до 1-2 мес |
65-90 |
Хотя предпочтительнее купировать ФП как можно раньше, некоторым пациентам может быть применен медленный метод восстановления синусового ритма (метод «жди-и-смотри») с помощью перорального приема амиодарона. Если через 1-2 месяца нет эффекта препарата, можно провести электрическую кардиоверсию.
Парентеральное купирование. Наиболее эффективны для восстановления синусового ритма препараты 1С и 3 класса (таблица 22). Вместе с тем препараты 1А и 1С класса могут вызвать выраженную тахикардию (часто ширококомплексную), связанную с появлением медленного трепетания с АВ проведением 1:1. Для предупреждения такой ситуации рекомендуют предварительно ввести антагонисты кальция (5-10 мг верапамила), бета-блокаторы (пропранолол 0,1 мг/кг) или дигоксин (0,75-1 мг). Пропафенон снижает АВ проведение намного слабее, чем бета-блокаторы и этого эффекта часто бывает недостаточно.
Некоторые специалисты после введения основной дозы антиаритмического препарата для повышения эффективности кардиоверсии и профилактики ранних рецидивов ФП рекомендуют продолжать низкодозовую инфузию, например, прокаинамид 2 мг/мин или пропафенон 0,5 мг/мин до 2 ч.
Антиаритмический эффект амиодарона в первые 2-6 ч не отличается от плацебо, но через 24 ч частота восстановления синусового ритма сопоставима с препаратами 1С класса (Chevalier P., et al., 2003). Более эффективно внутривенное введение препарата с последующей инфузией (Khan I.A., et al., 2003). Амиодарон может снизить АД, но не влияет на сократимость миокарда и внутрижелудочковую проводимость. При наличии структурного поражения сердца и факторов, снижающих вероятность купирования аритмии, возможно введение высоких доз амиодарона - 125 мг/ч в течение 24 ч (Cotter G., et al., 1999).
Отечественный препарат нибентан обладает высокой антиаритмической активностью при ФП, однако может вызывать значительное удлинение интервала QTc и двунаправлено-веретенообразную желудочковую тахикардию.
Для восстановления синусового ритма широко применяется электрическая кардиоверсия, эффективность которой значительно выше (7090%), чем медикаментов.
Таблица 22
Парентеральные препараты для купирования ФП (Jung F., et al., 1998; ESC, 2010; ICSI, 2007; ACCF/AHA/HRS, 2011)
|
Класс |
Препарат |
Схема ведения |
Время кардиоверсии |
Эффект % |
|
1А |
Прокаинамид |
1000 мг, скорость 2030 мг/мин |
5 мин-5 ч |
20-65 |
|
1С |
Этацизин |
25 мг за 5-10 мин |
Нет данных |
60 |
|
Пропафенон |
1,5-2 мг/кг за 10-20 мин |
30 мин-2 ч |
40-90 |
|
|
3 |
Амиодарон |
5 мг/кг за 60 мин и далее инфузия 50 мг/ч |
6-24 ч |
40-90 |
|
|
Вернакалант |
3 мг/кг за 10 мин, через 15 мин 2 мг/кг за 10 мин |
5-30 мин |
50 |
Электрическая кардиоверсия
Чаще всего используют трансторакальную кардиоверсию, эффективность которой повышается с увеличением разряда, но возрастает риск повреждения миокарда. Существует неверное представление, что ФП можно эффективно купировать разрядом низкой величины. Предсердия располагаются относительно глубоко в грудной клетке, поэтому низкий разряд бывает часто недостаточен. При стойкой ФП эффективность монофазных разрядов в 100, 200 и 360 дж составила 14%, 39% и 95% соответственно, поэтому рекомендуют начинать с разряда 200 дж, а в случае отсутствия эффекта с интервалом не менее 3 мин (для уменьшения повреждения миокарда) дают разряды в 300 и 360 дж (Joglar J.A., et al., 2000; Kowley P.R., et al., 1998). Если разряд в 360 дж был неэффективен, то нередко помогает изменение позиции электродов или сочетание со сдавлением грудной клетки. По-видимому, наиболее эффективно передне-заднее расположение электродов (Ewy G.A., 1994; Kirchhof P., et al., 2002).
Бифазный дефибриллятор позволяет снизить мощность разряда, повреждение кожи и мышц, и увеличить эффективность кардиоверсии (Gall
N.P., Murgatroyd F.D., 2007). Применяется более низкая стартовая мощность бифазного разряда - 100, 150, 200 и 360 дж.
При длительной Фп (более 30 сут) целесообразно начинать электрическую кардиоверсию с больших разрядов - 300-360 дж монофазного и 200-360 дж бифазного.
Интервал между двумя последовательными разрядами не должен быть менее 1 мин.
Гибридная кардиоверсия
При популярном гибридном методе восстановления синусового ритма вначале назначают антиаритмические препараты, а затем при неэффективности последних проводят ЭИТ. В этом случае увеличивается эффективность ЭИТ и снижается риск рецидива тахиаритмии.
Показан эффект хинидина, прокаинамида, пропафенона, амиодарона, ибутилида и дофетилида. В частности, ибутилид повышает вероятность восстановления синусового ритма на 30% и снижет мощность эффективного разряда (Oral H., et al., 1999).
В то же время медикаментозное лечение может повысить порог дефибрилляции (флекаинид), увеличить ЧСС (1А и 1С класс без предварительной АВ блокады), вызвать желудочковую тахиаритмию или тяжелую брадикардию при наличии дисфункции синусового узла.
Профилактика рецидивов
Если причину тахиаритмии не удается устранить, то без лечения ФП рецидивирует в течение года в 80% случаев. Факторами риска рецидива аритмии считают следующие (Van Gelder I.C., et al., 1996):
- возраст gt;55 лет,
- длительность аритмии gt;3 мес,
- сердечная недостаточность,
- ревматическое заболевание сердца,
- увеличение левого предсердия.
По-видимому, ИАПФ и БРА снижают риск появления и рецидивов ФП, особенно у пациентов с сердечной недостаточностью (Anand K., et al., 2006; Schneider M.P., et al., 2010).
Существуют противоречивые данные о профилактическом антиаритмическом эффекте статинов (GISSI-HF, 2009; SPARCL, 2011; Rahimi K., et al., 2011) и омега-3-полиненасыщенных жирных кислот (Kowey P.R., et al., 2010; Jarett D.B., et al., 2010; Nodari S., et al., 2011).
Противотромботическая терапия. В контролируемых исследованиях отмечено повышение частоты тромбоэмболий при рецидивирующей ФП, сравнимое с частотой тромбоэмболий при постоянной форме (например, 3,2% против 3,3% в исследовании SPAF). Рецидивирующая ФП нередко не выявляется при обычных медицинских осмотрах. В то же время по данным Фремингемского исследования у 54% пациентов с инсультом без анамнеза ФП выявлена рецидивирующая форма тахиаритмии (Lin H.J., et al., 1995).
В исследовании AFFIRM было показано что даже при профилактической антиаритмической терапии частота инсультов не отличалась достоверно от группы пациентов с контролем ЧСС. Причем большинство инсультов развилось после прекращения приема варфарина или при недостаточном антикоагуляционном эффекте.
Таким образом, и при рецидивирующей форме, особенно с факторами высокого риска, показана антикоагулянтная терапия.
Медикаментозная профилактика рецидивов
Существует два основных подхода при рецидивирующей ФП с использованием антиаритмических препаратов: постоянный профилактический прием антиаритмиков и периодическое восстановление синусового ритма без профилактического лечения.
При первом эпизоде ФП профилактическое лечение обычно не проводят, поскольку следующий эпизод аритмии может развиться через несколько месяцев и даже лет. Антиаритмическая терапия также не целесообразна в случае нечастой и хорошо переносимой пароксизмальной ФП.
Ставить целью профилактического лечения полное устранение рецидивов аритмии нереалистично. Рецидивы аритмии возникают в среднем в 50% случаев, несмотря на лечение, соответствующее современным рекомендациям. Более разумно стремиться к снижению частоты приступов, их длительности и выраженности симптомов.
В таблице 23 представлены препараты, использующиеся для профилактики ФП. По данным плацебо-контролируемых исследований большинство антиаритмических препаратов имеют близкую эффективность. Поэтому выбор препарата определятся в основном наличием структурного поражения сердца и сопутствующей патологией.
Таблица 23
Препараты для профилактики ФП (ESC, 2010; ВНОК/ВНОА, 2010; ACCF/AHA/HRS, 2011)
|
Класс |
Препарат |
Суточные дозы |
|
1А |
Хинидин |
300-750 мг 2 раза |
|
1С |
Пропафенон |
150-300 мг 3 раза |
|
Аллапинин |
75-100 мг |
|
|
Этацизин |
100-200 мг |
|
|
3 |
Амиодарон |
600 мг 1 мес, 400 мг 1 мес, затем 200 мг/сут |
|
Дронедарон |
400 мг 2 раза |
|
|
|
Соталол |
80-160 мг 2 раза |
Вместе с тем, заслуживают внимания результаты сравнительных испытаний препаратов, где было показано превосходство амиодарона перед препаратами 1 класса и соталолом. Например, в исследовании AFFIRM синусовый ритм сохранялся в течение года при лечении амиода- роном у 62%, препаратами 1 класса - у 23%, а соталолом - 38% пациентов. В исследовании SAFE-T среднее время рецидива ФП после восстановления синусового ритма при лечении амиодароном было в 4
- раза выше, чем при лечении соталолом, хотя у пациентов с ИБС эффективность препаратов достоверно не отличалась.
По данным недавно закончившегося исследования дронедарон - препарат структурно сходный с амиодароном без йода - в 2-2,5 раза удлинял продолжительность синусового ритма по сравнению с плацебо (Singh
- N., et al., 2007).
Если монотерапия неэффективна, то возможно подобрать комбинацию антиаритмических препаратов. Есть опыт сочетания бета-блокаторов, амиодарона или соталола с препаратами 1С класса (ACC/AHA/ESC, 2011). По данным исследования VEPARAF добавление верапамила к амиодарону или пропафенону снижало риск рецидива ФП после успешной кардиоверсии с 35 до 20% в течение ближайших 3 мес (De Simone A., et al., 2003).
Отсутствие структурного поражения сердца позволяет проводить лечение в амбулаторных условиях.
Хорошим эффектом обладают препараты 1С класса (пропафенон, флекаинид). Применяют также и соталол, наиболее оптимальный режим назначения которого, по-видимому, составляет 120 мг 2 раза в сут (Benditt D.J., et al., 1999). Лечение соталолом возможно если исходный интервал QTc не превышает 460 мсек, а в процессе лечения - 520 мсек (ACC/AHA/ESC, 2011).
Некогда очень популярный хинидин используется редко. Сдержанное отношение к этому препарату появилось после мета-анализа исследований длительного лечения хинидином, который выявил повышение летальности до 2,9% по сравнению с 0,9% в контрольной группе (Coplen S.E., et al., 1990). Однако более поздние сравнительные исследования этот вывод не подтвердили (Southworth M.R., et al., 1999; SOCESP).
В исследовании CTAF у 65% пациентов, получавших амиодарон (10 мг/кг/сут 2 нед, 300 мг/сут 4 нед и затем 200 мг/сут), в течение 16 мес рецидивов аритмии не было, а при лечении пропафеноном или соталолом синусовый ритм сохранялся лишь у 37% пациентов.
Вместе с тем, лечение амиодароном требует контроля функции щитовидной железы и трансаминаз (каждые 6 мес), а также рентгенографии грудной клетки (ежегодно). Недостатком препарата является очень медленное выведение из организма (до нескольких месяцев). Риск желудочковой тахиаритмии при удлинении интервала QT во время лечения амиодароном считается низким (lt;1%), поэтому электрокардиографический контроль рекомендуют не проводить, хотя описанный нами случай в разделе желудочковых тахикардий настораживает (ACC/AHA/ESC, 2011).
Структурное поражение сердца. Риск проаритмического действия препаратов повышается при структурном поражении сердца. Особенно часто осложнения развиваются в первые дни лечения, поэтому препарат лучше назначить в условиях стационара. Лечение проводят в стационаре до достижения насыщения (5 периодов полужизни препарата). Исключение составляет амиодарон с насыщающей дозой около 10 г. Какова оптимальная длительность лечения амиодароном в стационаре неясно, - обычно наблюдают в течение 4-5 дней.
В случае поражения сердца выбор препарата определяется сопутствующей патологией. При ИБС рекомендуют лечение соталолом, обладающим бета-блокирующим и антиангинальным эффектом. По данным мета-анализов рандомизированных исследований у пациентов после инфаркта миокарда амиодарон умеренно снижал общую летальность (на 13-29%), а препараты 1 класса повышали ее (ATMAI; Teo K.K., et al., 1993). Вместе с тем, у пожилых пациентов с ФП, перенесших инфаркт миокарда и принимающих амиодарон, более чем в 2 раза увеличилась частота имплантации ЭКС вследствие тяжелых брадикардий (Essebag V., et al., 2003).
ФП развивается в 40% случаев сердечной недостаточности, при которой особенно важно восстановление и поддержание синусового ритма, поскольку ФП снижает сердечный выброс на 10-20% независимо от частоты желудочкового ритма. Предпочтение отдают амиодарону, поскольку по данным мета-анализа крупных рандомизированных исследований (EPASMA, GESICA, CHF-STAT) у пациентов с сердечной недостаточностью показано снижение летальности (ACC/AHA/eSc, 2011). Заслуживает внимания и дофетилид, при лечении которым синусовый ритм восстановился у 59% пациентов и у 79% из них сохранялся в течение 1 года (DIAMOND). Важно отметить, что этот препарат не влиял на летальность после инфаркта миокарда и не усиливал дисфункцию левого желудочка.
Препараты 1 класса, особенно хинидин, могут повысить летальность при дисфункции левого желудочка согласно ретроспективному анализу исследования SPAF I. Кроме того, большинство препаратов 1А и 1С класса снижают сократимость миокарда.
При гипертоническом сердце возрастает риск ранней постдеполяризации, способной привести к возникновению двунаправленно
веретенообразной желудочковой тахикардии. Вследствие опасности лекарственных препаратов, удлиняющих интервал QT (1А, 3 класс), предпочтение отдают препаратам 1С класса, которые меньше влияют на интервал QT и не вызывают опасной желудочковой тахикардии (Prystowsky E.N., Katz A., 1997; Waldo A.L., Prystowsky E.N., 1998). В случае выраженной гипертрофии левого желудочка для снижения риска внезапной аритмической смерти предпочтительнее выглядит амиодарон.
Немедикаментозная профилактика рецидивов
Катетерная аблация. В последние годы широко применяют катетерную абляцию, которая позволяет изолировать источник аритмии в легочных венах и создать неблагоприятные условия для распространения патологических импульсов. Для определения места абляции обычно используют систему CARTO, которая позволяет на основе анализа внутриполостных электрических сигналов создать трехмерную геометрическую реконструкцию камеры сердца.
Обычно используют радиочастотное воздействие с формированием ожогового повреждения миокарда. Новая система криоабляции легочных вен (Freezor Cardiac CryoAblation Catheter) показала высокую эффективность при лечении пароксизмальной ФП, устойчивой к медикамента, и лишена традиционных осложнений радиочкстотной катетерной абляции.
Среди разработанных методик инвазивного катетерного лечения чаще используют круговую изоляцию легочных вен в левом предсердии, а также сегментарную изоляцию устьев легочных вен, фрагментацию задней стенки предсердия (HRS/EHRA/ECAS, 2007). В Научноисследовательском институте патологии кровообращения им.
Е.Н.Мешалкина развивают методику абляции ганглионарных сплетений в предсердиях, которая может быть эффективна при пароксизмальной ФП (Шабанов В.В., и соавт., 2010).
В случае сочетания ФП c типичным или индуцируемым истмус- зависимым трепетанием предсердий проводится также абляция кавотри- куспидального перешейка.
Кроме показаний, описанных в таблице 24, планируя лечение следует учитывать снижение эффективности процедуры при значительном увеличении левого предсердия, выраженном снижении функции левого желудочка, длительной персистирующей ФП, тяжелых заболеваниях легких, а также повышенный риск тромбоэмболий и перфорации миокарда у пожилых пациентов (ACCF/AHA/HRS, 2011; таблица 25).
Исходы аблации достоверно лучше в случае восстановления синусового ритма до 7 сут с помощью медикаментозной или электрической кар- диовресии, по сравнению с пациентами, у которых ФП сохранялась от недели до года перед инвазивным лечением (Winkle R.A., et al., 2011). В этой связи авторы рекомендуют прекратить аритмию как можно раньше перед проведением аблации.
Лечение бессимтомных ФП с помощью абляции считается нецелесообразным.
В целом абляция при ФП более опасна для пациента, чем абляция при других аритмиях, что связано с большей областью повреждения ткани, повышенной суммарной энергией, риском системной тромбоэмболии и близким расположением диафрагмального нерва, легочных вен и пищевода.
Применение 3-дневного курса кортикостероидов (гидрокортизон 2 мг/кг в день процедуры и 0,5 мг/кг преднизолона внутрь в течение 3 сут) снижает риск ФП в ближайшие дни и вплоть до 14 мес (Koyama T., et al., 2010).
Однократная абляция позволяет добиться устойчивого синусового ритма при пароксизмальной ФП в 38-78%, при персистирующей ФП - в 22-45% случаев, и показала высокую эффективность. Например, в исследовании F.Ouyang и соавт. (2010), изоляция легочных вен у пациентов с пароксизмальной ФП и нормальной функцией левого желудочка привела к сохранению синусового ритма после вмешательства в 80% случаев, а через 5 лет - в 46% случаев. Восстановление утраченной изоляции легочных вен после второй и третьей процедуры было эффективным в 94 и 67% случаев. В другом исследовании через 1, 2 и 5 лет после катетерной абляции синусовый ритм сохранялся в 40, 37 и 29% случаев с максимальной частотой рецидивов в первые 6 мес (Weerasooriya R., et al., 2011).
Таблица 24
Показания для немедикаментозного лечения ФП (HRS/EHRA/ECAS, 2007)
Катетерная абляция
- Симптомная ФП c рефрактерностью или непереносимостью по меньшей мере 1 или 3 класса антиаритмических препаратов.
- В редких случаях возможно выполнить абляцию ФП в качестве первоначальной терапии.
- Выбранные пациенты с симптомной ФП и сердечной недостаточностью или сниженной фракцией выброса.
- Наличие тромбов в левом предсердии является противопоказанием к катетерной абляции ФП.
Хирургическая абляция ФП
- Пациенты с симптомной ФП и потребностью в другой операции на сердце.
- Выбранные пациенты с асимптомной ФП, которым проводится операция на сердце и возможна абляция ФП с минимальным риском.
- Хирургическая абляция ФП при симптомной ФП, если пациенты предпочитают хирургический подход, имеются безуспешные катетерные абляции или абляция не показана.
Таблица 25
Показания для катетерной аблации ФП (ACC/AHA/ESC, 2011)
11а класс (больше данных в пользу эффективности)
Катетерная абляция - возможная альтернатива фармакологическому лечения для предупреждения рецидивов ФП у симптомных пациентов с нормальными или немного увеличенными размерами левого предсердия.
Исследования свидетельствуют о большей эффективности абляции по сравнению с медикаментозным лечением. Например, по данным исследования STOP AF пациентов с пароксизмальной ФП после криоаблации в течение года синусовый ритм сохранялся у 70%, против 7,3% на медикаментах (O'Riordan M., 2010). В случае неэффективности хотя бы одного антиаритмического препарата радиочастотная аблация была эффективна через 9 мес у 66% пациентов против 16% на медикаментах (Wilber D.J., et al., 2010).

Рис. 40. Эффективность аблации у пациентов с ФП через год по даннным мета-анализов.
По данным мета-анализов (рисунок 39) аблация была эффективнее медикаментозного лечения для контроля синусового ритма в течение года (Noheria A., et al., 2008; Calkins Y., et al., 2009; Terasawa T., et al., 2009). Наибольший эффект приносит аблация, если применяется после безуспешной антиаритмической терапии у пациентов до 60 лет, с сохраненной функцией сердца и немного увеличенным левым предсердием (в среднем 50 мм).
В то же время исследования, сравнивающие абляцию и медикаменты, имеют существенные ограничения, часть которых планируется преодолеть в текущем исследовании CABANA (AHA, 2011).
Важно знать, что годовая смертность и качество жизни после абляции и на медикаментозном лечении достоверно не отличались (Dagres N., et al., 2009).
Таблица 26
Противопоказания для немедикаментозного лечения ФП
- Возраст gt;70 лет.
- Постоянная ФП gt;5 лет.
- Левое предсердие gt;60 мм в диаметре.
- Хроническая сердечная недостаточность III-IV ФК.
- Уменьшение фракции выброса левого желудочка lt;35%.
- Некорригируемая патология сердца.
- Выраженные коморбидные заболевания.
- Ожирение.
- 3 месяца после острого соматического заболевания.
- 6 месяцев после операций на коронарных сосудах, достижения эутиреоза.
- 12 месяцев после операциях на клапанах сердца.
Среди осложнений абляции возможны тромбоэмболии (0-7%), инсульты (1-5%), тампонада сердца (1,2-6%), стеноз легочных вен (1,3-3,4%), повреждение пищевода (lt;0,3%), повреждение диафрагмального нерва (0-0,5%), ритмичные предсердные тахикардии (5-25%, обычно прекращающиеся через 3-6 мес), бедренная псевдоаневризма или артериовенозная фистула (0,4-0,5%). Применение катетеров с ирригационной системой на фоне лечения варфарином значительно снижает риск инсультов (Di Biase L., et al., 2010). Летальность процедуры составляет 1 случай на 1000 пациентов (Cappato R., et al., 2009).
При абляции в настоящее время применяют 3-мерные системы электрофизиологического картирования (CARTO, NavX), которые позволяют манипулировать катетерами бе
